| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... la relation entre l’électronégativité et le type de liaison ...
Lorsque 2 atomes A et B réagissent pour former un corps AB on peut prévoir le type de liaison qui va se constituer à partir de la nature des éléments et des valeurs de leurs électronégativités :

La connaissance de l’électronégativité des éléments chimiques permet également de donner le
nom le plus approprié à des molécules
telles que OF2, qui est un gaz. Le fluor est plus électronégatif que l'oxygène, par conséquent la formule limite de OF2
est alors O2+ + 2F-.
Comme l’anion F- est appelé fluorure, OF2 sera le difluorure d’oxygène mais le plus électropositif s'écrit en premier dans la formule chimique.
Application aux oxydes
Les oxydes basiques sont les oxydes fortement ioniques formés avec les alcalins, les alcalino-terreux, les terres rares et les oxydes de faible degré d’oxydation des métaux de transition.
Soit un oxyde ionique CaO avec Δχ > 1,5 (ici 2,5), l'action de l'eau est la suivante :
| soit |
CaO + H2O → Ca++ + 2 OH- ou Ca(OH)2
|
(FI >> 0,5 et donc χM < 1,4) |
Un oxyde métallique est souvent basique, un oxyde basique est toujours métallique.
Attention, l’EN varie en fonction du DO aussi les valeurs données dans la classification ne suffisent plus pour les composés comme Mn qui présentent de nombreux états d’oxydation.
Certains oxydes métalliques sont insolubles dans l’eau car ils ont un caractère covalent plus marqué (FeO, CuO, …).
Ils se solubilisent en milieu acide : CuO + 4 HCl → CuCl42-, 2H+ + H2O
Les oxydes acides sont les oxydes covalents formés avec les non métaux, le Te et les métaux de transition de fort degré d’oxydation (Mn, …).
L’atome central est fortement électrophile et dissocie H2O en réagissant avec OH- et en libérant H+.
Soit un oxyde covalent SO3 avec Δχ < 1,5 (ici 1), l'action de l'eau est la suivante :
| soit |
H2O + SO3 → SO4- - + 2 H+
ou H2SO4 |
(FI << 0,5 et donc χM' > 2,1) |
Un oxyde covalent (CO2, SO3, N2O5, …) par réaction avec l'eau donne un acide fortement oxygéné (H2CO3, H2SO4, HNO3, ...) on dit que cet oxyde est un anhydride d'acide.
Comme exception, on peut citer SiO2 qui polymérise et est insoluble dans l’eau, il n’est soluble qu’en milieu basique fort pour donner les silicates.
Les oxydes amphotères sont les oxydes aux propriétés intermédiaires, avec une ionicité comprise entre environ 40% et 60%, en général insolubles à pH = 7 mais solubles en :
- milieu acide pour former des cations solvatés (Al2O3 + 6 H+ → 2 Al3+ + H2O)
- milieu basique pour donner des anions oxygénés selon (Al2O3 + 2 OH- → 2 AlO2- + H2O)
Le calcul de l'ionicité (FI) permet donc de savoir si un oxyde est de type ionique ou covalent.
Les limitations cinétiques rendent certains oxydes neutres (CO, NO, N2O, …) insolubles à température ambiante.
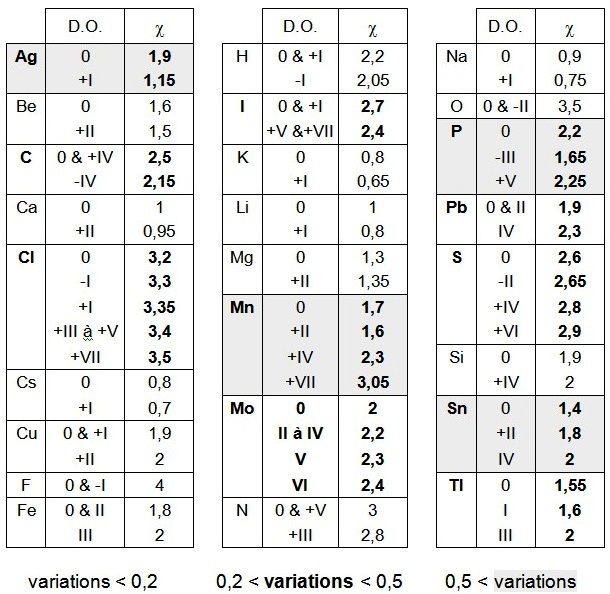 |
On constate qu’en première approximation les valeurs de l'électronégativité proposées par Pauling (souvent
pour DO = 0 ou II) permettent de répondre à la plupart des interrogation d'un chimiste. Quelques éléments nécessitent des valeurs complémentaires à celles de la classification car l’électronégativité dépend du degré d’oxydation de l’élément (généralement, elle augmente avec l’état d’oxydation).
On a grisé les cases des 4 éléments dont la variation de l'électronégativité est supérieure à 0,5. Pour la plupart des éléments, la variation est faible ou nulle (voir H, F, N, Pb, ...) sauf pour les degrés d'oxydation particuliers (-1 pour H, ...) ou les degrés d'oxydation élevés (+IV pour Pb, ...). |
Le caractère covalent influence d'autres paramètres comme enthalpie de formation.
| Pr Robert Valls | robert.valls@univ-amu.fr |