| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

RÉACTIVITE DES FAMILLES D'ÉLÉMENTS
Connaissances ... définir ... l'électronégativité ...
L'électronégativité (EN ou χ) d'un élément est la tendance que possède cet élément à attirer à lui les électrons de la liaison.
C’est un concept introduit par Pauling en 1932.
Il existe différentes échelles d’électronégativité : de Linus Pauling (échelle thermochimique), d’Alred et Rochow (force électrostatique du noyau sur les électrons de valence), de Phillips (électronégativité diélectrique), de Sanderson (densité électronique relative) … mais c’est celle de Pauling qui est la plus couramment utilisée par les chimistes.
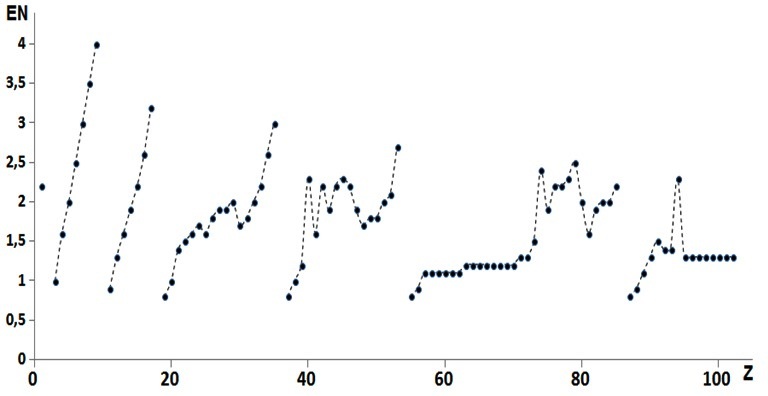
En l’utilisant, on constate que :
- dans une
famille (colonne) l'électronégativité (et les rayons atomiques) diminue lorsque Z croît.
- dans une
période (ligne) l'électronégativité augmente lorsque Z croît.
- à la droite du tableau périodique on rencontre les éléments les plus électronégatifs,
ce sont les non métaux
(ils ont tendance à attirer les
électrons lorsque des atomes de ces éléments sont engagés dans une liaison chimique).
- à la gauche du tableau périodique, on rencontre les éléments les moins électronégatifs, ils sont électropositifs, ce sont les
métaux
(ils ont tendance à perdre des électrons ou à peu retenir les électrons lorsqu'ils forment une liaison).
Nature des éléments en fonction de leur indice d’électronégativité ou plus simplement leur électronégativité :
cliquer sur la figure pour retrouver l'état initial
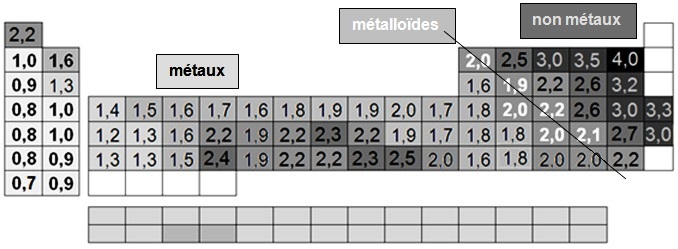
• Les éléments situés à gauche et en dessous de la diagonale descendante qui est définie dans la bloc p (colonnes 13 à 18) sont tous des métaux, leur EN est généralement inférieure à 2
• Les éléments qui constituent cette diagonale, sont appelés semi-métaux ou métalloïdes, leur EN est généralement voisine de 2
• Les autres éléments, à droite et au dessus de cette diagonale sont des non métaux, leur EN est supérieure à 2
Les rayons atomiques et l’EN varient donc globalement de manière opposée (l’hydrogène est une exception).
On note que l’augmentation de la taille des atomes avec Z (augmentation du nombre des électrons qui augmente leur force de répulsion) est
antagoniste avec l’attraction croissante avec Z, qu’exerce le noyau sur les électrons (qui contracte les couches électroniques).
L’attraction noyau-électron l’emporte sur la répulsion électron-électron et les rayons atomiques ne varient que d’un rapport de 1 à 8
alors que Z varie de 1 à 100.
La courbe de l'électronégativité en fonction de Z permet, après avoir situé les métalloïdes (puis la diagonale) de situer les non métaux et restent les métaux (en noir) avec des exceptions (en bleu, métaux avec EN > 2 et l'Hydrogène).
cliquer sur la figure pour retrouver l'état initial
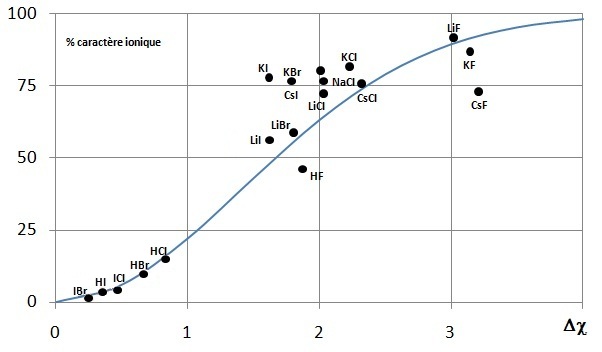
La différence d'électronégativité entre atomes liés A et B Δχ = χA - χB est donc une mesure directe de la distribution électronique des électrons de valence qui assurent la liaison chimique.
Cette différence est le critère qui permet de classer les liaisons chimiques par type :

Pauling (Américain, Prix NOBEL de Chimie en 1954, mort en 1994) définit l’électronégativité comme la tendance d’un atome engagé dans
une liaison à attirer à lui les électrons de cette liaison. Noter que l’EN est relative et n’a de sens que pour les atomes liés.
La courbe théorique est proposée avec les valeurs expérimentales pour quelques halogénures et quelques hydrures non métalliques.
non métalliques sont covalents (80 à 100% mais 55% pour HF) et les halogénures métalliques sont ioniques (60 à 85%).
Par soucis d'homogénéité, la plupart des valeurs numériques sont extraites d'un seul ouvrage dont je peux
vous envoyer les références par courriel.
| Pr Robert Valls | robert.valls@univ-amu.fr |