| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

NOMENCLATURE DES COMPOSÉS INORGANIQUES
Connaissances ... décrire ... La nomenclature utilisée pour les composés inorganiques ...
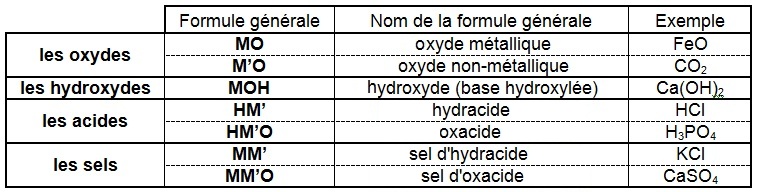
Pour obtenir des formules générales pour les corps purs composés :
• on remplace les symboles des éléments métalliques par le symbole général M, non métalliques par le symbole général M’
• on conserve les symboles de l'oxygène O (valence II) et de l'hydrogène H (valence I)
• on supprime les indices et les parenthèses
Il y a 7 catégories de corps purs composés qui permettent de désigner tous les composés inorganiques pour lesquels :
on écrit d'abord M lorsqu'il est présent (MO, MOH, MM' et MM'O), ou M' (M'O) si M est absent
sauf pour les acides où l'on écrit d'abord H (HM' et HM'O) conformément à leur écriture (HCl, HNO3, ...)
et les hydroxydes que l'on écrit MOH pour mettre en évidence l'hydroxyde
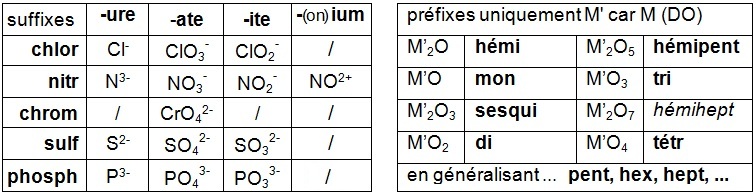
Il intervient également l'utilisation des suffixes et des préfixes.
• Pour les composés en chaîne avec plus de deux éléments différents, l’ordre d’écriture doit coïncider avec l’ordre d’enchaînement des atomes. Par exemple : HOCN ou H-O-C≡N, HNCO ou H-N=C=O, ...
• S’il y a un atome central, il est placé en premier, sauf pour les acides : SbCl2F (ordre alphabétique), H2SO4, HNO3 …
• L'écriture des composés = NaCl, CaO, ... et la lecture, sont en ordre inverse = chlorure de sodium, oxyde de calcium, ...
• Par convention, on écrit toujours, les éléments du moins électronégatif au plus électronégatif : LiH, HCl, H2SO4, CCl4, etc ...
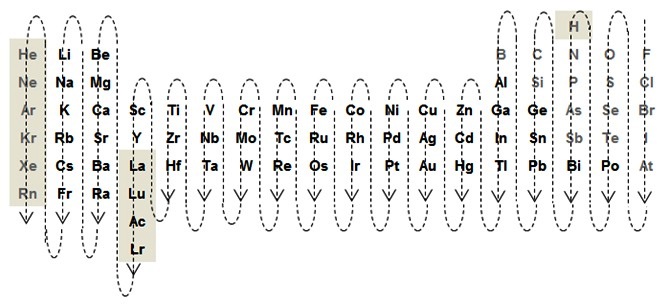
il y a quelques exceptions dues à la tradition puisque pour les composés binaires entre non métaux, on place en tête l’élément le plus
à gauche dans la séquence : Rn, Xe, Kr, Ar, Ne, He, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Par exemple : XeF2, H2S, NH3, S2Cl2, OF2, B2H6, ...
Attention, pour les nommer, on inverse fluorure de xénon, sulfure d’hydrogène …
• Les composés intermétalliques sont nommés dans l’ordre alphabétique des symboles : Cu5Zn8, MnTa3N4 (avec le non métal en dernier).
• Dans un composé binaire, le nom du plus électronégatif se termine en "–ure" : Na2Pb = Plombure de sodium, AsNi = arséniure de nickel,
BiPt bismuthure de platine, H2S sulfure d’hydrogène, OF2 fluorure d’oxygène, LiH hydrure de Lithium, …
L’attribution de la terminaison "–ure" se fait selon la séquence précédente :
Rn, Xe, Kr, Ar, Ne, He, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F et pour les autres éléments, dans l’ordre suivant :
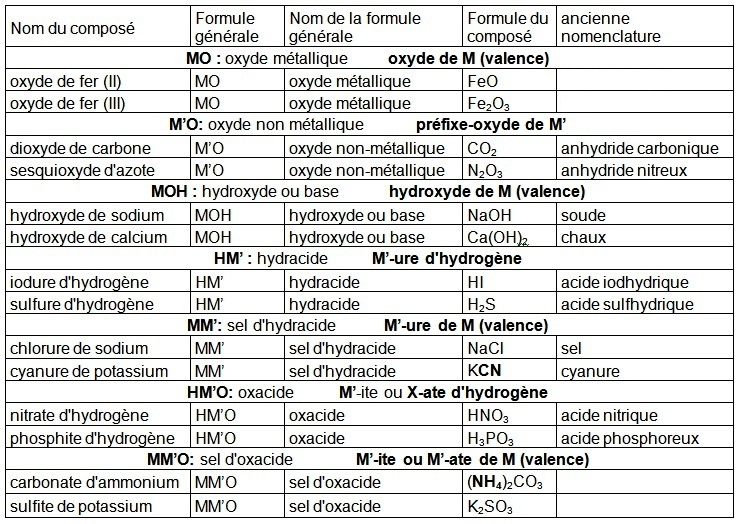
Quelques exemples à lire attentivement avant de passer aux exercices.
| Pr Robert Valls | robert.valls@univ-amu.fr |