| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

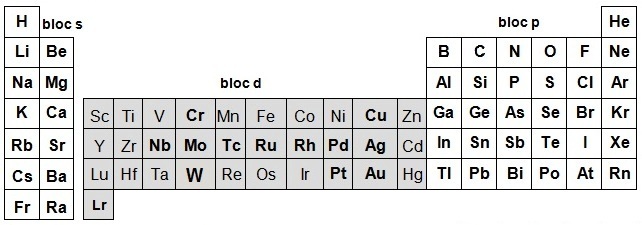
ÉTUDE DES FAMILLES D'ÉLÉMENTS : le bloc d
Connaissances ... nommer et situer ... les familles du bloc d ...
Le bloc d est souvent traité globalement car sa réactivité chimique est relativement homogène mais on peut décrire :
- la colonne 3 : les homologues des terres rares (sachant que les terres rares sont un groupe de métaux aux propriétés voisines comprenant la colonne 3 et les quinze lanthanides 57La à 71Lu).
- la colonne 4 : les métaux et métalloïdes tétravalents
- la colonne 5 : la famille du Vanadium
- la colonne 6 : la famille du Chrome
- la colonne 7 : la famille du Manganèse
- la colonne 8 : la famille du fer (les métaux magnétiques = Fe, Co et Ni)
- la colonne 9 : la famille du Palladium
- la colonne 10 : la famille du Platine
- la colonne 11 : la famille des métaux nobles
- la colonne 12 : la famille du Zinc
Les éléments d regroupent une partie de la famille que l’on appelle les métaux de transition l'autre partie étant la colonne 12.
On appelle métaux de transition, les éléments présentant une couche d partiellement remplie dans l’un de leur degré d’oxydation courant aussi Zn, Cd et Hg en sont exclus car la sous couche d est saturée ainsi que Lu et Lr qui font respectivement partie des lanthanides et des actinides (au delà de Lr, les éléments jusqu'à Rg sont aussi des éléments de transition mais ils ne sont pas traités dans ce cours).
On note que ces métaux de transition présentent une couche d ou f partiellement remplies dans l’un de leur degré d’oxydation courant sans que l’on puisse proposer de justification simple pour tous (voir les exercices).
Généralement, les propriétés des éléments varient beaucoup le long d’une période mais pas pour les éléments d, ils ont beaucoup de similitudes et constituent une "série" chimique car il est délicat de parler de famille dans une période.
La configuration électronique des éléments du bloc d (en gras) ne respecte pas toujours la règle de Klechkowski (ils peuvent avoir des orbitales d et s d’énergie comparable ou privilégier une orbitale d ou s remplie ou semi remplies).
Par exemple le cuivre qui devrait avoir la configuration [Ar] 3d94s2 adopte [Ar] 3d104s1 qui correspond à une sous couche d complète et une sous couche s semi complète (plus stable que l’inverse), de même pour Ag et Au.
Par exemple le chrome qui devrait avoir la configuration [Ar] 3d44s2 adopte [Ar] 3d54s1 qui correspond à une sous couche d semi complète et une sous couche s aussi semi complète (plus stable qu’une sous couche s complète mais une sous couche d avec 4 électrons), de même pour Mo mais W respecte la règle.
Par exemple le palladium qui devrait avoir la configuration [Kr] 4d85s2 adopte [Kr] 4d105s0 qui correspond à une sous couche d complète et une sous couche s vide.
Par contre dans la même famille, le Ni respecte une répartition classique (mais ce sont les sous couches 4s et 3d) et le Pt adopte [Xe] 5d96s1 (mais ce sont les sous couches 6s et 5d).
| Pr Robert Valls | robert.valls@univ-amu.fr |