| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Connaissances ... définir ... les ions ...
Le type d’ion formé par un élément peut être facilement déduit à partir de sa position dans la classification car généralement :
| ♦ la colonne 1 donne des cations +1 | |
| ♦ la colonne 2 donne des cations +2 | |
| ♦ la colonne 3 donne des cations +3 | ♦ la colonne 13 donne des cations +3 |
| ♦ la colonne 4 donne des cations +4 à +2 | ♦ la colonne 14 ne donne pas d'ions sauf pour les métaux (+4 et +2) |
| ♦ la colonne 5 donne des cations +5 à +2 |
♦ la colonne
15 donne des cations +5 et +3 pour les métaux (Po)
et les anions -3 pour les non métaux (N et P) |
| ♦ la colonne 6 donne des cations +6 à +2 | ♦ la colonne 16 donne des anions -2 sauf pour les métalloïdes |
| ♦ la colonne 7 donne des cations +7 à +2 | ♦ la colonne 17 donne des anions -1 (EO = +1 à +7 dans les molécules) |
| ♦ la colonne 8 donne des cations +8 à +2 (Fe +3 et +2) | ♦ la colonne 18 ne donne pas d'ions |
| ♦ la colonne 9 donne des cations +7 à +2 | |
| ♦ la colonne 10 donne des cations +4 à +2 | |
| ♦ la colonne 11 donne des cations +3 à +1 | |
| ♦ la colonne 12 donne des cations +2 |
Un ion est un atome qui a perdu (positif, cation) ou gagné (négatif, anion) des électrons et qui peut être stable dans cet état.
A un cation de charge +1 (Na+ par exemple), on attribue un degré d’oxydation (DO) ou nombre d'oxydation de +I que l’on note par un chiffre romain au dessus du métal selon l'écriture suivante :
cliquer sur la figure pour retrouver l'état initial
![]()
Le nombre d’oxydation d’un élément chimique dans un édifice polyatomique permet de déterminer l’état d’oxydation de cet élément.
On vient de voir que l'on peut généraliser cette notion et noter le DO par un
chiffre romain algébrique, il décrit le nombre
de charges fictives (ou réelles) portées par cet élément.
Ce degré d'oxydation est une notion très pratique car si les formules des substances chimiques sont déterminées expérimentalement cette recherche est longue et difficile. Aussi, à partir des formules connues, les chimistes ont construit des méthodes pour les retrouver de manière théorique et ils ont mis au point un outil mathématique, le degré d'oxydation (nombre attribué à chaque atome dans un édifice atomique : molécule, ion, complexe ...) et qui est indispensable pour expliquer les réactions d'oxydoréduction.
La détermination de cette charges fictives (ou réelle) obéit aux règles suivantes :
• dans un édifice polyatomique si deux éléments chimiques sont liés, les électrons mis en jeu dans cette liaison sont arbitrairement attribués à l’élément le plus électronégatif
• dans un édifice polyatomique, la conservation de la charge électrique impose que la somme des nombres d’oxydation des différents éléments composant l’édifice soit égale à la charge globale de l’édifice (nulle s'il s'agit d'une molécule neutre ou d'un élément isolé)
Certains éléments ont des DO relativement stables et on attribue le DO
de +I à H
(sauf dans les hydrures -I) et de -II à O (sauf dans les peroxydes -I)
et il est alors possible de déterminer un DO pour les éléments qui les accompagnent.
Par exemple, prenons CaCO3, qui donne l'ion CO32- a deux charges négatives, Ca a un DO
de +II et comme on a proposé -II pour O,
C dans CO32- peut être affecté d'un DO fictif
ou état d'oxydation (EO) de +IV qui
ne signifie pas que l'ion C4+ existe
mais qui explique le composé CaCO3.
On a résumé dans un tableau, les ions correspondant aux 36 premiers éléments, l'ensemble de la classification sera présenté par
la suite :
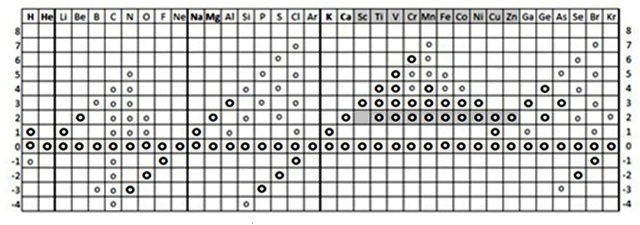
cliquer sur la figure pour retrouver l'état initial
Les
grands cercles indiquent les
DO des ions simples et les
petits cercles indiquent les états d'oxydation (EO) ou DO fictif des
éléments généralement dans des ions polyatomiques souvent oxygénés qui se forment avec les éléments à fort EO.
Par exemple :
CO2 où C = +IV
N2O5 où N = +V, SF6 où S = +VI KMnO4
où Mn = +VII ...
Remarque : Le DO ne caractérise pas toujours la charge d’un ion (sauf pour les métaux) car si l’ion Na+ existe en solution avec
un DO de +I, par contre, N5+ ne peut exister sous cette forme, N étant un non métal et je vous propose d'utiliser le terme
d'état d'oxydation (EO) pour indiquer que l'ion monoatomique n'existe
pas.
• Na donne des liaisons ioniques dans NaCl et les ions Na+ (DO +I) et Cl-
(DO -I) sont stables.
• N donne des liaisons covalentes dans par exemple N2O5 qui donne avec H2O,
2 HNO3 qui, lui conduit aux ions H3O+ et NO3-.
Pour ce dernier, on peut appliquer le DO :
3 O (-II) avec globalement une charge négative conduit bien à un état d'oxydation de +V pour N.
On peut l'appliquer à N2O5, molécule neutre, qui donne -II
x 5 = -10 pour les O et +V x 2 = +10 pour le N (et -10 + +10 = 0).
Remarque : Le problème du carbone
se pose puisqu'on peut lui attribuer 4 électrons, soit les attribuer aux atomes auxquels il est lié
alors qu'il ne donne que des liaisons covalentes.
Il ne donne pas d’ion au sens réel de la définition mais des
états d'oxydation (EO) qui prennent toutes les valeurs de +IV à -IV :
CH4 où EOC = -IV CH3-CH3 où EOC = -III CH3F où EOC = -II CH2F-CH2F où EOC = -I
C graphite ou diamant, CH2O, ... où EOC = 0
CO2 où EOC = +IV CO2H-CO2H où EOC = +III HCO2H où EOC = +II CHF2-CHF2 où EOC = +I
Dans ce cas, cette notion a peu d'intérêt car il s'agit de liaisons covalentes.
| Pr Robert Valls | robert.valls@univ-amu.fr |