| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Chimie
inorganique
descriptive
Je consulte
des ressources
sur iut en ligne

ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Connaissances ... connaître ... les lignes de la classification ... les caractéristiques des blocs ... les ions les plus probables ...
Exercice de reformulation à partir des connaissances acquises avec le cours et les exercices.
Pour mémoriser les trois premières lignes de la classification, il est proposé deux phrases :
ligne 1 : H et He
sont à retenir sans oublier que He est positionné au-dessus de la colonne des gaz rares
ligne 2 : Lili Bêla Bien Chez Notre Oncle François-Nestor
ligne 3 : Napoléon Mange Allègrement Six Poulets Sans Claquer d'Argent
Il ne s'agit pas que d'apprendre la classification périodique bien que cela permette de chercher le Cl à droite et Na à gauche et non l'inverse, mais plutôt de savoir l'utiliser efficacement.
Il est donc préférable de comprendre la logique de la construction de la classification et qu'à partir de la position d'un élément dans celle-ci,
on soit capable de déduire, la formule ionique associée ou le nombre de liaisons de covalence simples que peut former l'atome
correspondant à cet élément.
Les blocs peuvent être caractérisés par quelques caractéristiques simples :
Le bloc s est constitué de métaux, il correspond aux colonnes 1 et 2 du tableau périodique (alcalins et des alcalino-terreux) qui donnent respectivement aux ions X+ et X2+.
Le bloc p est constitué de métaux, de non métaux et de métalloïdes (colonnes 13 à 18).
colonne 18 = gaz rares très stables chimiquement colonne 17 = halogènes, ions
X- colonne 16 = chalcogènes, ions X2-
Le bloc d n'est constitué que de métaux et contient les premières exceptions à la règle de Klechkowski (le Chrome et le Cuivre).
Le bloc f est placé sous la classification périodique pour la rendre plus compacte.
Les ions formés par les éléments sont liés à leur position dans la classification :
|
ions positifs ...
X+ colonne 1 et 11 X2+ colonne 2 et 12 mais aussi 3 à 12 X3+ colonne 3 et 13 et lanthanides (actinides) |
X4+ colonne 4 et 14 X5+ colonne 5 (sous forme de structures fortement oxygénées) X6+ colonne 6 (sous forme de structures fortement oxygénées) X7+ colonne 7 (sous forme de structures fortement oxygénées) |
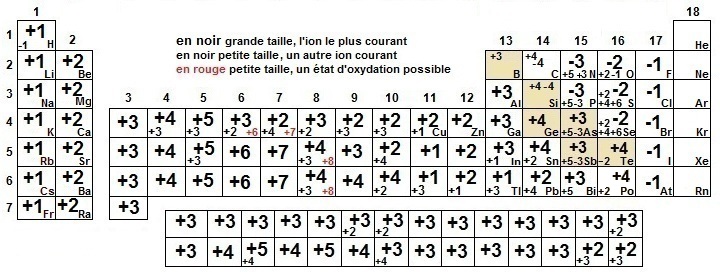 |
ions négatifs ... X- colonne 17 X2- colonne 16 (en partie) X3- colonne 15 (en partie)
états d'oxydation positifs
colonne 13 à 16 |
On peut facilement expliquer l'existence des ions isoélectroniques
1s2 et
ceux qui ont une sous couche p complète
np6
ou une sous couche d complète
nd10
avec une sous couche s vide (et p)
et enfin ceux qui ont les sous couche s et d complètes
nd10(n+1)s2 soit
au
total.
Seuls 11 ions du bloc d et la majorité des ions du bloc f ont des répartition électronique plus complexes à justifier ainsi que des métalloïdes et des non métaux qui ont un comportement les conduisant à perdre ou gagner des électrons selon l'environnement.
| Pr Robert Valls | robert.valls@univ-amu.fr |