|
|
|
N° des raies |
Rapport = d1 / dn |
| ||||
|
plans |
h2 + k2 + l2 |
P |
I |
F |
P |
I |
F |
dhkl |
|
100 |
1 |
1 |
|
|
1 |
|
|
a√1 |
|
110 |
2 |
2 |
1 |
|
√2 |
1 |
|
a√2 |
|
111 |
3 |
3 |
|
1 |
√3 |
|
1 |
a√3 |
|
200 |
4 |
4 |
2 |
2 |
√4 |
√2 |
√4/3 |
a√4 |
|
210 |
5 |
5 |
|
|
√5 |
|
|
a√5 |
|
211 |
6 |
6 |
3 |
|
√6 |
√3 |
|
a√6 |
|
220 |
8 |
7 |
4 |
3 |
√8 |
√4 |
√8/3 |
a√8 |
|
221 |
9 |
8 |
|
|
√9 |
|
|
a√9 |
|
310 |
10 |
9 |
5 |
|
√10 |
√5 |
|
a√10 |
|
311 |
11 |
10 |
|
4 |
√11 |
|
√11/3 |
ne |
|
222 |
12 |
11 |
6 |
5 |
√12 |
√6 |
√12/3 |
|
|
320 |
13 |
12 |
|
|
√13 |
|
|
pas |
|
321 |
14 |
13 |
7 |
|
√14 |
√7 |
|
|
|
400 |
16 |
14 |
8 |
6 |
√16 |
√8 |
√16/3 |
remplir |
|
c'est à vous de terminer le tableau ! |
||||||||
|
N° raie |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
angle lu |
25,70° |
29,76° |
42,58° |
50,40° |
52,81° |
61,80° |
68,06° |
70,08° |
77,95° |
83,69° |
93,15° |
|
dhkl en pm |
346,4 | 300,0 | 212,1 |
180,9 |
173,2 | 150,0 | 137,6 | 134,2 | 122,5 | 115,5 | 106,1 |
|
dhkl = f(a) |
a/√3 | a/√4 | a/√8 | a/√11 | a/√12 | a/√16 | a/√19 | a/√20 | a/√24 | a/√27 | a/√32 |
|
plan |
111 | 200 | 220 | 311 | 222 | 400 | 331 | 420 | 422 | 333 | 440 |
|
Cocher les cases qui s'appliquent |
conductivité électrique élevée |
résistance à la corrosion |
légèreté et bonne résistance mécanique |
transmission de la lumière |
résistance mécanique élevée |
faible conductivité thermique |
|
Composite carbone-carbone (aéronautique) |
|
|
X |
|
|
|
|
Acier (bâtiment) |
|
|
|
|
X |
|
|
Cuivre pur (électricité) |
X |
|
|
|
|
|
|
Alumine - Al2O3 (industrie thermique) |
|
|
|
|
|
X |
|
Verre sodocalcique |
|
|
|
X |
|
|
|
Acier inoxydable |
|
X |
|
|
|
|
| a- La conductivité électrique est la plus élevée pour............................................ : |
les métaux
|
X |
les alliages
|
|
||
| b- Lorsque la température augmente, la conductivité électrique des métaux... : |
augmente |
|
diminue |
X |
||
| c- Lequel de ces métaux a une structure cristalline de type cubique centrée... : |
Fer α
|
X |
plomb |
|
cuivre |
|
| a- Le verre normal solide à une structure....................................................................... | amorphe |
X |
cristalline |
|
||
| b- Après l'ajout d'oxyde sodium dans un verre à base de silice la température de fusion.. | augmente |
|
diminue |
X |
||
| c- Dans une céramique les liaisons sont préférentiellement......................................... | ioniques |
|
ionocovalentes |
X |
covalentes |
|
| c- Section parallèle aux feuillets ou perpendiculaire aux feuillets................................ | parallèle |
X |
perpendiculaire |
|
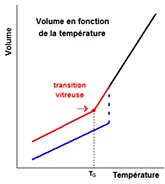
| e- Indiquer sur la figure ci-contre où se trouve le point de transition vitreuse : |
 |
|
a- Quel type de dopage augmente le nombre d'électrons libres dans un semi-conducteur : |
type P |
|
type N |
X |
|
|
b- Quel est le nom de la bande d'énergie entre la bande de valence et celle de conduction : |
bande interdite |
ou |
gap |
||
Pour plus de détails cliquer sur les titres mais seulement si vous ne
trouvez pas !