Polarité des molécules
Avant de décrire les interactions, il faut décrire les phénomènes qui
interviennent dans les molécules.
Soit une liaison entre deux atomes A et B différents et donc d'électronégativités différentes (χ
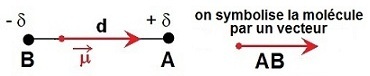
Le doublet liant n’est plus symétrique : les électrons
se rapprochent de l’atome
le plus électronégatif.
Un dipôle est créé, cette notion a été décrite.
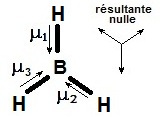
On peut généraliser aux molécules polyatomiques :

● certaines molécules sont apolaires BH
3
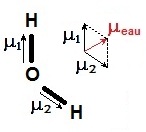
● d'autres sont polaires OH
2