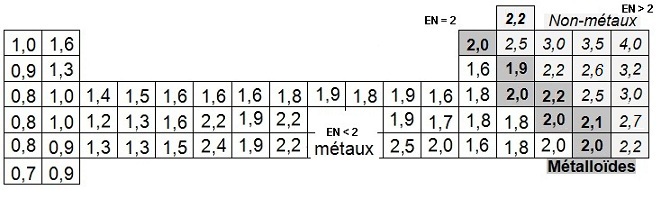
- dans une famille (= colonne) l'électronégativité diminue lorsque Z augmente.
- dans une période (= ligne) l'électronégativité augmente lorsque Z augmente.
- à la droite du tableau périodique on rencontre les éléments les plus électronégatifs : ce sont les non métaux (ils ont
tendance à attirer les électrons lorsque des atomes de ces éléments sont engagés dans une liaison chimique).
- à la gauche du tableau périodique on rencontre les éléments les moins électronégatifs : ce sont les métaux (ils ont
tendance à perdre des électrons ou à peu retenir les électrons lorsqu'ils forment une liaison chimique : on dit qu'ils sont
électropositifs).
cliquer sur la figure pour retrouver l'état initial