CONSTRUCTION DE LA CLASSIFICATION PÉRIODIQUE
Mémoriser ...
Les trois premières lignes de la classification avec les phrases suivantes :
H et He
Lili Bêla Bien Chez Notre Oncle François-Nestor.
Napoléon Mange Allègrement Six Poulets
Sans Claquer d'Argent.
La valeur de l'électronégativité des éléments les plus répandus :
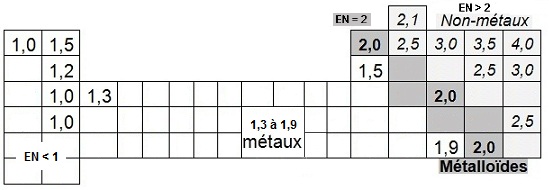 |
- les métaux ont une électronégativité
comprise entre 1,3 et 1,9 (hors mis les
alcalins et alcalino-terreux)
- les alcalins ont une électronégativité
de 1 pour Li puis inférieures
- les alcalino-terreux ont une
électronégativité de 1,5 Bé, 1,2 pour
Mg et 1 ou moins pour les suivants |
- les éléments de transition ou métalloïdes ont une électronégativité voisine de 2
- les non métaux ont une électronégativité supérieure à 2 (les valeurs espacées de 0,5 sont indiquées)
- H est particulier, il a une électronégativité de 2,1
L'ordre de grandeur des énergies de première ionisation :
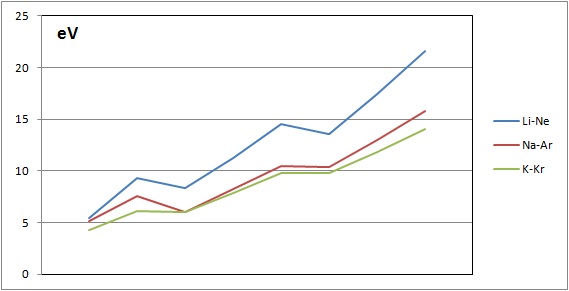 |
- environ 5 électrons volts pour les
alcalins et 3 fois plus pour les gaz
rares
- une évolution croissante le long
d'une période, avec une anomalie
liée à la sous couche s pleine et à
la sous couche p
demi remplie
- une diminution de toutes les
valeurs au fur et à mesure que l'on
croit dans les périodes |
Les valeurs des rayons covalents et ioniques des éléments courants :
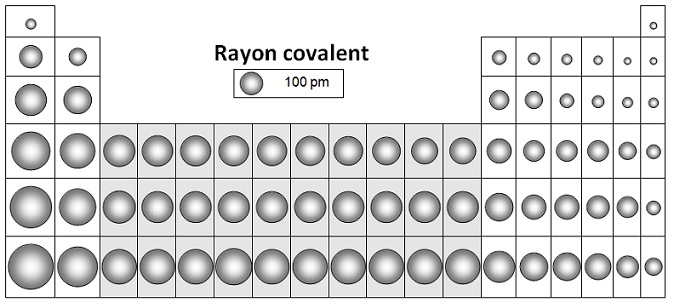
Les plus petits rayons sont ceux des gaz rares et les rayons augmentent en descendant la classification ainsi qu'en la
parcourant une période de droite à gauche.
L'évolution de ces différentes grandeurs dans la
classification :
- L'électronégativité croit le long des périodes et décroit le long des familles
(les gaz rares sont exclus).
La plus grande valeur se situe en haut à droite, Fluor = 4
La plus petite en bas à gauche, Francium = 0,7
Attention : l'Hydrogène est à part
- Les énergies de première ionisation augmentent le long des périodes (horizontalement de gauche à droite) et
diminuent le long des familles (verticalement de haut en bas).
La plus grande valeur se situe en haut à droite, Hélium = 24,6 eV
La plus petite en bas à gauche, Francium ≈ 4 eV
Attention : l'Hydrogène est à part
- les rayons covalents décroit le long des périodes et croit le long des familles.
La plus grande valeur se situe en bas à gauche, Francium ≈ 300 pm
La plus petite en haut à droite, Hélium ≈ 30 pm
Atomistique et liaison chimique
Construction de la classification

Pr Robert Valls
robert.valls@univ-amu.fr


