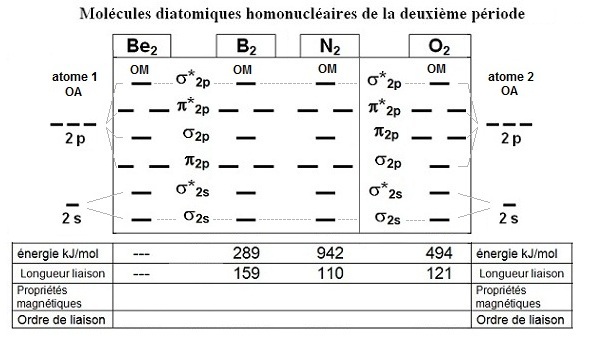

a- Compléter le diagramme en indiquant les électrons, en calculant l’ordre des liaisons et en donnant les propriétés magnétiques.
b- Expliquer la molécule Be2 pourquoi n'existe pas.
c- Expliquer l'inversion qui intervient entre l'Azote et l'Oxygène.
d- Commenter les valeurs des longueurs de liaison, les ordre de grandeur, leur évolution et la relation avec les énergies de liaison.

b- L'indice de liaison de la molécule de Be2 est égal à 0 puisqu'il y a autant d'électrons dans les orbitales moléculaires
liantes que dans les orbitales moléculaires anti liantes. La création de la molécule n'apporte aucun gain d'énergie,
la molécule n'existe pas.
c- L'énergie de toutes les orbitales croît lorsque Z augmente mais l'énergie des OM σ2p augmente plus vite que celle des
OM π2p d'un atome donné et après l'oxygène il y a un croisement qui provoque l'inversion.
d- Plus la liaison est multiple, plus elle est courte et plus son énergie est grande. C'est une évolution qui est généralement
respectée si l'on considère les valeurs moyennes.