La liaison chimique ... Nature, propriétés et symbolisation de la liaison chimique ...
Compléter le diagramme des OM pour les éléments de la deuxième période (Li2, Be2, B2, C2, N2,
O2 et F2) proposé
ci-dessous, calculer l’ordre des liaisons et donner les propriétés magnétiques.
On peut présenter ce diagramme en échelle d'énergie relative pour mieux comprendre l'inversion
après l'azote :
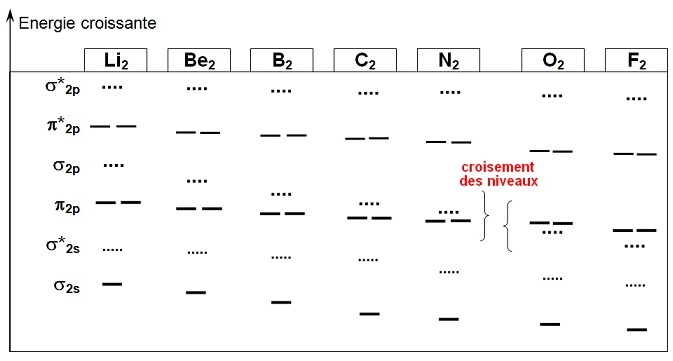 |
On constate que globalement,
que
l'énergie des orbitales moléculaires
descend* dans l'échelle
proposée
mais que l'énergie
de l'orbitale σ2p
descend plus rapidement que celle
de l'orbitale π2p aussi, on
observe
une inversion entre l'azote et
l'oxygène.
*l'échelle est négative aussi lorsque
l'énergie augmente, elle est plus
importante
en valeur absolue et
précédée
du signe
moins, elle descend dans
l'échelle
proposée. Pensez au
croisement
des
énergies
des orbitales atomiques s
et d
que nous
avons vu précédemment.
|
Ci-dessous, on complète le schéma proposé par les électrons correspondant à chacun des atomes :
La
molécule Li2
est possible puisque son indice de liaison est de (2 - 0) /
2 = 1
La
molécule Be2
ne peut exister puisque son indice de liaison est de (2 -
2) / 2 = 0 donc il n'y a pas de
stabilisation
apportée par la création de la molécule (il n'y a pas d'énergie ni de longueur de
liaison).
La
molécule B2
est possible puisque sont indice de liaison est de (4 -
2) / 2 = 1
les deux orbitales π2p sont de même énergie et comme pour les orbitales
atomiques (règle de Hund)
leur remplissage se
fera par un électron de spin positif avant de compléter avec
un deuxième de spin
négatif aussi cette molécule présentera
des propriétés magnétiques (il possède
des électrons
célibataires ou non appariés).
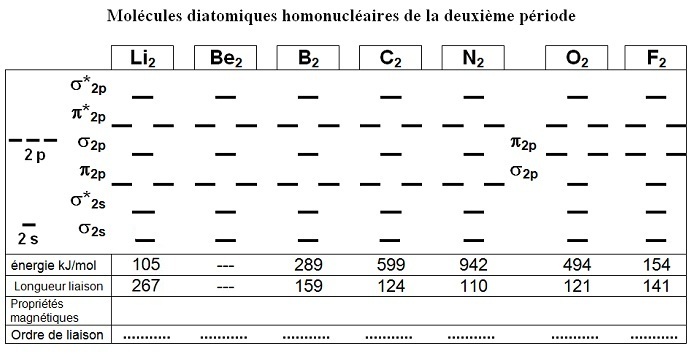 |
La
molécule C2
est possible
puisque son indice de liaison
est de (6 -
2) / 2 = 2
La
molécule N2
est possible
puisque son indice de liaison
est de (8 -
2) / 2 = 3
C'est la molécule qui
possède le plus d'électrons
dans les niveaux liants et
simultanément le moins
dans
les niveaux non
liants.
La
molécule O2
est possible
puisque son indice de liaison
est de (8 -
4) / 2 = 2
Comme pour B2
la répartition
|
des électrons conduit à des
électrons non appariés qui conféreront des propriétés
magnétiques à la molécule.
Le modèle de Lewis ne permet pas
d'expliquer ce phénomène
et cette théorie complète
parfaitement celle de Lewis.
La
molécule F2
est possible puisque son indice de liaison est de (8 -
6) / 2 = 1
On
constate que deux molécules possèdent des propriétés magnétiques qui sont
expliquées par cette
théorie.
Les énergies de liaison en kJ/mol. sont de :
• 105, 154 et 289 correspond aux indices de liaison de 1
• 494 et 589 correspond aux indices de liaison de 2
• 942 correspond aux indices de liaison de 3
On peut en déduire des ordres de grandeur des liaisons simples (100 à 300), doubles
(500 à 600) ou
triples (900 à 1000).
Pour les longueurs de liaison, il est plus difficile de proposer des conclusions
simples car la taille des
atomes intervient
également.
Pensez à vérifier vos acquis et cochez les cases
 à la première page lorsque vous vous sentez capable de répondre à la requête proposée.
à la première page lorsque vous vous sentez capable de répondre à la requête proposée.

