I- La liaison chimique - Il s'agit de donner les éléments les plus importants proposés en cours sur la définition de la
liaison chimique.
a- On a précisé que "la liaison chimique est une écriture, une représentation et une symbolique".
Commenter cette définition à partir d'un exemple simple.
b- La liaison est de type covalent, ionique et métallique. Compléter les différents types en commentant chaque type par
quelques phrases.
c- Le fait que la molécule de méthane soit totalement symétrique ne s'explique que par le phénomène d'hybridation des
orbitales de l'atome de carbone. Commenter en quelques phrases.
II- Géométrie des molécules - Soient les cinq molécules suivantes :
NH3, BH3, SeH2, CaH2, B2S3 et PCl5.
a- Dessiner ces molécules selon la représentation de Lewis.
b- Dessiner une géométrie pour ces molécules et indiquer la valeur des angles entre liaisons ou/et le type de figure
géométrique (linéaire, tétraèdre, bipyramide, …).
c- On fait réagir BH3 avec NH3, ce qui donne la molécule H3B-NH3. Donner la géométrie de ce cette molécule.
d- En solution aqueuse, en présence d'ions Cl-, AlCl3 donne des ions AlCl4- selon la réaction :
AlCl3 + Cl- → AlCl4-
Expliquer la formation l'ions AlCl4- et donner sa structure électronique et sa géométrie exacte.
Où se trouve la charge négative ? Expliquer.
III- Effet inductif en mésomère - Répondre aux questions suivantes :
a- Expliquer grâce à l'effet mésomère la stabilité de l'ion sulfate SO4--.
b- Ecrire les formes mésomères du nitrobenzène.
c- Ecrire les formes mésomères de l'aldéhyde salicylique et de ses isomère méta et para substitués.
(aldéhyde salicylique = benzène ortho substitué par une fonction -CHO aldéhyde et une fonction -OH alcool)
IV- Symbolisation de la liaison chimique - On propose la réaction suivante :
CH3OH + CH2=CH-COCl → CH2=CH-COCH3 + HCl
a- Représenter tous les électrons en leur donnant la couleur de l'atome auquel il appartient.
b- Proposer une géométrie (angles de liaison et figure géométrique) pour les différentes molécules.
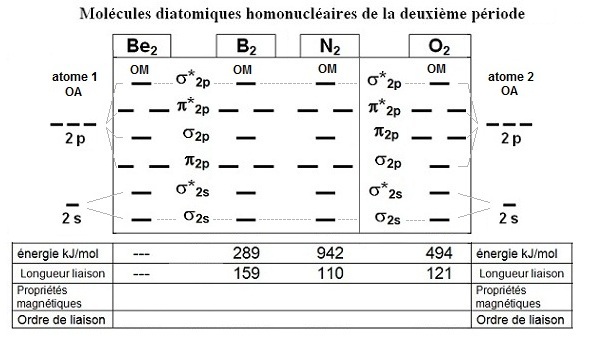
V- Diagramme des orbitales moléculaires - Soit le diagramme des orbitales moléculaires (OM) pour quelques
éléments de la deuxième période (Be2, B2, C2, N2 et O2) proposé ci-dessous.

a- Compléter le diagramme en indiquant les électrons, en calculant l’ordre des liaisons et en donnant les propriétés
magnétiques.
b- Expliquer la molécule Be2 pourquoi n'existe pas.
c- Expliquer l'inversion qui intervient entre l'Azote et l'Oxygène.
d- Commenter les valeurs des longueurs de liaison, les ordre de grandeur, leur évolution et la relation avec les énergies
de liaison.
VI- Représenter une molécule à partir de la formule brute
On donne la formule brute d'une molécule carbonée C4H5ON.
Sachant que l'on propose la présence de la fonction amine (-NH2), de la fonction cétone (R-CO-R') et d'une triple liaison
(-C≡C-), il y a deux possibilités à trouver et à traiter pour chaque question.
a- Dessiner selon la représentation de Lewis les deux molécules possibles et préciser l'atome d'appartenance de chaque
électron (par des couleurs par exemple).
b- Dessiner en perspective, donner les hybridations des atomes de carbone, la valeur des angles de liaison et le type de
géométrie en nomenclature VSEPR pour chaque molécule (AXE).
VII- Les états de la matière - On donne un diagramme d'état d'un corps pur.
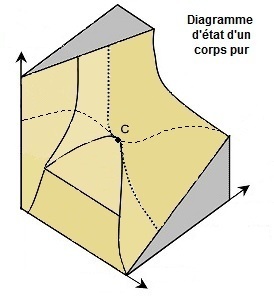
a- Positionner correctement les mots : pression, température, volume, solide,
liquide, vapeur et supercritique.
b- Dessiner en perspective, donner les hybridations des atomes de carbone,
la valeur des angles de liaison et le type de géométrie en nomenclature
VSEPR pour chaque molécule (AXE).
c- Que représente le point C ?
Que représente la zone plus foncée contenant le point C ?
Que représente la courbe en pointillés ?
d- Caractériser par une phrase : les solides, les liquides et les gaz.
e- Le
passage de l'état solide à l'état gazeux s'accompagne de changements
importants de quels paramètres. Donner des ordres de grandeur de ces
variations.
f- Commenter l'état plasma en quelques phrases.
VIII- Les composés inorganiques - Compléter les tableaux suivants :
|
Al(OH)4- |
ion |
.......................................... |
CO32- |
ion |
.......................................... |
HS- |
ion |
.......................................... |
|
NH2- |
ion |
.......................................... |
ClO3- |
ion |
.......................................... |
H3O+ |
ion |
.......................................... |
|
NH4+ |
ion |
.......................................... |
ClO2- |
ion |
.......................................... |
OH- |
ion |
.......................................... |
|
BO33- |
ion |
.......................................... |
Cl- |
ion |
.......................................... |
H- |
ion |
.......................................... |
|
Br- |
ion |
.......................................... |
OCN- |
ion |
.......................................... |
NO2- |
ion |
.......................................... |
|
…… |
ion |
bromate |
…… |
ion |
cyanure |
…… |
ion |
hypochlorite |
Commentaires sur Al(OH)4- : ………………………………………………………………………………………………….
| Composé | nom | formule | nom de la formule | nom commun s'il existe |
| H2SO4 | ||||
| KCN | ||||
| K2SO3 | ||||
| MgO | ||||
| (NH4)2CO3 | ||||
| PbCl4 | ||||
| N2O3 | ||||
| CaBr2 | ||||
| Cu(OH)2 | ||||
| ................ | hydroxyde d’ammonium | |||
| ................ | sulfure d’hydrogène |
1- ……………………………………………………………………………………………………………………………………
2- ……………………………………………………………………………………………………………………………………