On sait que la chimie repose sur le principe de conservation de la masse (Lavoisier) que l'on peut résumer par
"dans une réaction chimique, la nature des corps en présence se modifie mais la masse totale ne varie pas".
La liaison chimique est une représentation qui est en général la représentation de Lewis.
H 2 + 1/2 O 2 → H 2 O
que l'on peut écrire :
![]()
La première écriture permet de visualiser les électrons de valence qui vont participer à la réaction et la deuxième montre
l'atome auquel appartient chaque électron.
La liaison chimique est une symbolique car les molécules possèdent des doublets non liants qui vont jouer un rôle
important dans la géométrie et la réactivité des molécules.
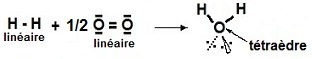
L'ensemble des données (géométriques) est présent dans l'esprit du
chimiste à travers l'écriture particulièrement simplificatrice :
H 2 + 1/2 O 2 → H 2 O
L'ensemble des données nécessaires à la compréhension complète de la signification des traits qui entourent les atomes
et qui symbolisent les liaisons (ou les doublet non liants) doivent implicitement découler de l'écriture de la réaction.
b- La liaison est de type covalent peut être décrite de manière simplifiée par une paire d'électrons située principalement
dans l'espace se trouvant entre deux noyaux atomiques où ils sont soumis à l'influence de ces deux noyaux. Parallèlement,
les électrons présents entre les noyaux empêchent leur répulsion et de plus, ils les attirent et les amènent à se rapprocher
au lieu de se repousser.
Cette situation tend à maintenir le noyau et les électrons dans une configuration stable bien qu'ils soient libres de se
mouvoir en accord avec les contraintes de la mécanique quantique.
La liaison est fortement directionnelle et localisée aussi les molécules, liées par des liaisons de covalence tendent à
adopter des géométries caractéristiques possédant des angles de liaison spécifiques.
La liaison de type ionique est le phénomène physique qui lie les atomes entre eux par des forces électrostatiques.
Elle peut être décrite, en simplifiant, par le fait qu'un ou plusieurs électrons sont transférés d'un atome à un autre et un
des atomes devient un ion positif et l'autre un ion négatif.
La liaison est donc due à une attraction électrostatique entre les ions formés et il n'y a plus de paires d'atomes liés comme
pour la liaison covalente.
Les atomes sont liés par attraction coulombienne non-directionnelle qui concerne un grand nombre d'atomes
simultanément (les anions et les cations s'attirent mutuellement dans toutes les directions de l'espace).
La liaison ionique pure n'existe pas et tous les composés présentent un degré de liaison covalente.
Les atomes s'empilent de différentes manières pour aboutir simultanément à une neutralité électrique et à une proximité
maximale des charges opposées.
La liaison totalement ionique n'existe pas (contrairement à la liaison covalente) et on constate que plus la différence
d'électronégativité entre deux atomes est importante, plus la liaison est ionique.
On peut calculer le pourcentage de caractère ionique d'une liaison à partir du moment dipolaire.
La liaison de type métallique permet la cohésion des atomes d'un métal. Elle concerne simultanément un très grand
nombre d'atomes (plusieurs millions au moins). Ces atomes mettent en commun un ou plusieurs électrons, appelés
"électrons libres" qui sont à l'origine de la conductivité électrique des métaux. Contrairement à la liaison covalente, on peut
voir les électrons libres comme des électrons délocalisés à toute la pièce métallique et les atomes sont empilés comme
par exemple des balles de ping-pong. Ces empilements sont non compacts (52% de vide) ou compacts (26% de
vide). Les caractéristiques physiques des métaux tels que la malléabilité, la ductilité, la conductivité de la chaleur
s'expliquent par la nature de cette liaison.
Avec l'avènement de la mécanique quantique ce modèle a reçu une interprétation plus formelle dans le modèle d'électrons
quasi-libres où les électrons sont considérés comme un gaz voyageant à travers la trame du solide.
c- Le carbone a pour structure électronique 1s 2
2s 2
2p 2
que l'on peut représenter sous forme de cases quantiques pour
mettre en évidence les électrons célibataires
![]()
qui sont au nombre de deux, conduisant à deux liaisons et donc à la molécule CH 2.
Or nous savons que la chimie du carbone est basée sur la valence 4.
Il a donc été proposé un état excité du carbone, que l'on peut représenter par ![]()
et dans lequel il y a bien quatre orbitales atomiques (OA) incomplètes autour du carbone.
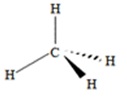
Il y a donc 1 orbitale atomique s et 3 orbitales atomiques p et par exemple, la molécule CH4 ne peut être totalement
symétrique (les 4 OA n'étant pas identiques). Il a été proposé que les trois orbitales atomiques p et l’orbitale atomique s
se combinent (s’hybrident) pour donner quatre orbitales moléculaires (OM) dites sp 3 (combinaison de linéaire de 1
orbitale atomique s et de 3 orbitales atomiques p). On attribut à cette interprétation l'acronyme anglais L.C.A.O.
(combinaison linéaire d'orbitales atomiques).
 (1s2) 2s2
2p2 donnent (1s2)
2s1
2p3 ou (1s2) 2s2
2px1 , 2py1
et 2pz0
(1s2) 2s2
2p2 donnent (1s2)
2s1
2p3 ou (1s2) 2s2
2px1 , 2py1
et 2pz0
à l'état excité on obtient (1s2) 2s2
2px1 , 2py1 et 2pz1 et par combinaison
des 4 orbitales atomiques (s + 3p), on obtient 4 OM hybrides de même type
nommées h1 , h'1 , h"1
et h'"1 (qui donnent des liaisons équivalentes de type σ)
et la molécule CH4 est donc parfaitement symétrique.