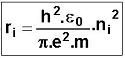
Modèles électroniques de l’atome
Différents modèles de l’atome ont été proposés, dans l’ordre historique, le modèle planétaire de
Rutherford, puis le
modèle de Bohr et le modèle ondulatoire.
Modèle de Rutherford
L’électron gravite autour du noyau en décrivant une orbite circulaire de rayon r avec une vitesse
uniforme. Ce modèle
n’était pas compatible avec les résultats expérimentaux mais avait le mérite
d’être le premier modèle proposé pour
la structure de l’atome.
Modèle de Bohr
Planck propose la théorie des quanta dans laquelle les systèmes qui émettent un rayonnement le font
par sauts d’énergie
h
À partir de cette théorie, Bohr a postulé :
- seules certaines orbites électroniques sont possibles
- sur une orbite donnée, l’électron n’émet ni n’absorbe aucune radiation
- il y a émission ou absorption d’une radiation lorsque l’électron passe d’une orbite à l’autre
| On démontre que |
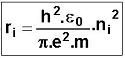 |
ni est le nombre quantique principal |
| De même, on obtient : |
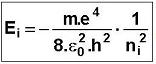 |
qui conduit à E1 = - 13,6 eV |
| Les énergies des niveaux supérieurs étant liés par l'expression : | Ei = E0 |
| ni2 |
Pour interpréter complètement les résultats expérimentaux, un autre modèle est nécessaire c'est le modèle ondulatoire.
Modèle ondulatoire
La mécanique classique permet de définir à tout instant, la position et la
vitesse d'une particule. En
mécanique quantique
ou mécanique ondulatoire on ne peut calculer que des probabilités de présence
en un point donné ou en dans un état
donné.
Schrödinger a le premier défini l’équation dont les solutions permettent de déterminer la probabilité
de présence de
l’électron.
On décrit un système de particules (atome) par une fonction d’onde psi qui
s’écrit
Ψ (x, y, z, t) et qui n'a
aucune
signification physique mais le carré de son module
Ψ2 représente
la probabilité de présence de
l'électron par exemple
dans un volume donné (pour que la
probabilité de
présence soit de 1, il faut un volume infini).
L’équation de Schrödinger peut s’écrire sous la forme HΨ = E Ψ (cette fonction sera
détaillée dans la suite
de vos études).
Pour que les calculs soient utiles, on défini une valeur
de la probabilité de présence de
l'électron (95 %) qui conduise à
une région de l’espace cohérente avec les
propriétés des molécules.
Le volume qui a 95% de chances de contenir l'électron délimite un volume appelé orbitale.
On obtient des solutions stationnaires associée à l’électron, ce caractère stationnaire signifie que
l’électron peut rester
indéfiniment sur la même orbite et donc cette fonction ne
considère pas la
variable temps.
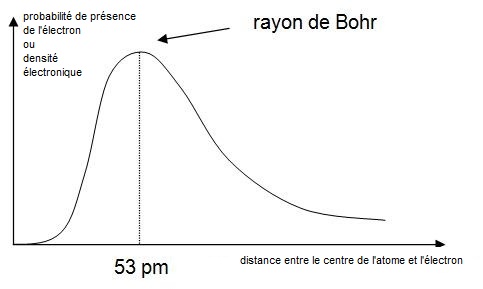 |
Pour l’atome d’hydrogène, la résolution de l’équation conduit, par exemple, à la courbe de probabilité
de présence ci-contre pour l'orbitale 1s. Cette équation ne peut être résolue dans l’état actuel de nos connaissances pour un atome quelconque. A partir de certaines approximations on obtient la forme des orbitales atomiques proposées au paragraphe suivant. On utilise aussi des méthodes approchées comme la méthode de Slater pour calculer certaines propriétés des atomes. |
Atomistique et liaison chimique
Structure électronique de l'atome
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr