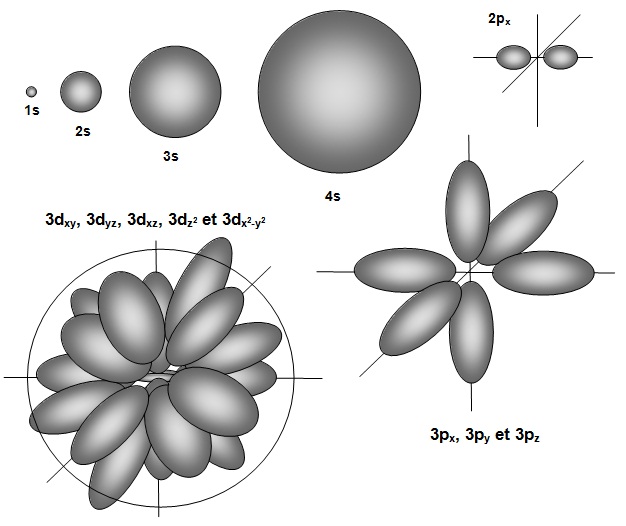
Les orbitales s, p, d et f
L’équation de Schrödinger conduit à des équations, mais il est difficile de les représenter. Aussi,
la trajectoire de
l’électron sera représentée par le dessin du volume qui englobe une probabilité de
présence donnée. Nous dirons
qu’autour du noyau existent des régions dans lesquelles l’électron
a une probabilité de 95 % de se trouver (c’est une
orbitale) sachant qu’une probabilité de 100 %
englobe tout l’espace.
On observe des volumes de type sphérique pour les orbitales s et par des volumes plus ou moins
complexes pour les
autres type d'orbitales.
On désigne les orbitales par les lettres s, p, d, f, g, ... (selon le nombre quantique l).
Leur représentation est obtenue à partir de l'enveloppe de l'espace ayant
95 % de chance de
contenir l'électron ou les
électrons de l'orbitale. On obtient des orbitales
s
sphériques, p avec deux
lobes orientés selon les trois directions de
l'espace (ce sont les orbitales px, py
et pz) et d à deux
lobes comme les p mais orientés dans l'espace libre (selon les
axes xy, yz et xz puis deux types
d'orbitales d particulières nommées x2 et x2- y2).

Si l'on représente l’atome correspondant à la superposition de toutes ces orbitales, on peut donc
l'assimiler à une sphère
dans laquelle des électrons se déplacent sur des orbitales mais qu'il est
difficile de représenter aussi, on propose une
enveloppe sphérique qui englobe toutes les orbitales.
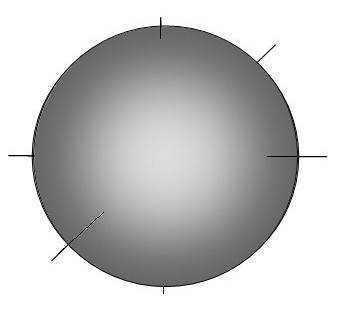
L’atome ressemblerait donc à une sphère que l'on peut comparer
à une ville vue d'un satellite, les électrons en sont les habitants
les rues en sont les orbitales.
Bien que vue d’en haut le mouvement
des électrons (les habitants) soit
incompréhensible, chacun d’eux a
un parcours logique et prévisible, par exemple, il part faire ses
courses en revient chez lui (son orbitale).
Notez que le parcours est différent chaque jour mais que globalement
il part de chez lui et y revient régulièrement (c'est bien une orbitale).
On note que la représentation des orbitales des atomes à la même
échelle est difficile, car leur taille varie selon l’atome (plus le noyau
est chargé et plus il attire les électrons aussi, l’orbitale 1s, par
exemple, d’un atome lourd est beaucoup plus petite que celle de
l’hydrogène.