Nature, propriétés et symbolisation de la liaison chimique
Lorsqu’un atome s’approche d’un autre atome, les conditions peuvent être telles qu’ils s’unissent et l'on
dit qu’il y a
liaison. On note que ce sont les électrons les plus externes de l'atome (de la couche de
valence) qui interviennent
les autres
étant fortement retenus par le noyau et nécessitant des énergies
bien plus grandes que celle de ce type de liaison pour
être déplacés (voir les énergies d'ionisation).
A l’échelle macroscopique, on peut faire une analogie en considérant deux aimants qui s’unissent
s’ils sont suffisamment
près et bien orientés (conditions de liaison) puis il faut dépenser de l'énergie
pour les séparer (après liaison, la molécule est
plus stable que les atomes séparés).
Mais on peut se demander
pourquoi deux atomes s’attirent jusqu’à se lier alors que leurs
cortèges
électroniques (contrairement au
cas des aimants bien orientés) devraient les amener à se
repousser.
Pour décrire cette liaison, on peut donner quelques indications sur la liaison covalente,
qui peut être
décrite de manière
simplifiée par une paire d'électrons
située principalement dans
l'espace se trouvant entre deux noyaux où ils sont soumis
à
l'influence des deux noyaux liés. Parallèlement, les électrons
présents entre les noyaux empêchent la
répulsion des
noyaux et ils les attirent, les amenant à se
rapprocher au
lieu de se repousser.
Cette situation tend à maintenir le noyau et
les
électrons dans une
configuration stable tout en les laissant tous libres de se mouvoir en accord
avec les contraintes de
la
mécanique
quantique.
Pour les molécules polyatomiques, la liaison chimique est le résultat d’une réaction chimique :
● la première étape est le contact des molécules que l'on favorise en chauffant les réactifs par
exemple (on leur donne
une énergie cinétique qui va compenser la répulsion)
● la deuxième étape est le partage des électrons de liaison qui ne se fera que si le résultat de la
liaison conduit à une
molécule plus stable..
La liaison chimique est d'abord une écriture (d'une réaction), une
représentation (des molécules
avec leurs liaisons) et
une symbolique
(de la représentation des molécules).
![]() une écriture : C + O
une écriture : C + O
Il faut avoir à l'esprit que la chimie repose sur le principe de
conservation de la masse proposé
par Lavoisier que l'on
peut résumer à la phrase "dans une réaction chimique, la nature des corps
en
présence se modifie mais la masse
totale ne varie pas".
![]() une représentation : La plus simple et la plus utilisée est la représentation de Lewis
qui peut
être
utilisée pour la
une représentation : La plus simple et la plus utilisée est la représentation de Lewis
qui peut
être
utilisée pour la
réaction
CO
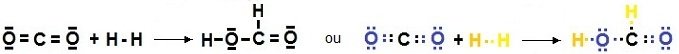
La première écriture (classique) permet de visualiser les électrons de la
couche de valence qui vont participer à la
réaction et la
deuxième montre l'atome auquel appartient chaque électron.
Un
trait représente une liaison lorsqu'il lie des atomes et un doublet non liant quand il n'est pas
entouré de deux atomes.
![]() une symbolique : Les molécules possèdent des doublets non liants qui vont jouer un rôle
important dans la
une symbolique : Les molécules possèdent des doublets non liants qui vont jouer un rôle
important dans la
géométrie et la réactivité des molécules.
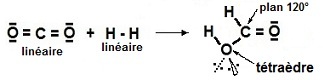
L'ensemble de ces données est (implicitement)
présent dans l'esprit du chimiste à travers l'écriture
particulièrement
simplificatrice :
CO
Atomistique et liaison chimique
La liaison chimique
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr