Représentation des molécules en utilisant la règle VSEPR
Pour expliquer la géométrie des molécules on est parti de deux idées de base :
- la géométrie des molécules n’est conditionnée que par le nombre de paires électroniques dans la couche de valence de
l’atome central,
- l’orientation relative des OM est déterminée par le principe de répulsion maximale des paires d’électrons (les paires
d’électrons libres ont une force de répulsion plus grande).
On désigne par VSEPR (Valence
Shell Electron
Pair Repulsion de R.J Gillespie) cette façon de raisonner qui conduit aux
schémas suivants :

La formation des orbitales moléculaires hybrides (qui correspond à une redistribution de la densité électronique au niveau de la couche
de valence) est telle que, après formation des liaisons σ , l'édifice polyatomique (molécule ou ion) ainsi formé adopte une
géométrie qui minimise les répulsions entre les nuages électroniques (orbitales moléculaires)).
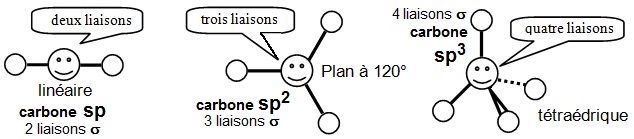
Remarque : imaginons que l'on dispose de charges de même nature reliées par des liens,
- elles se repousseraient le plus loin possible,
- une charge centrale reliée à 2 charges donnerait le premier schéma,
- 3 charges se placeraient sur un plan à 120° et si une charge sort du plan, elle se rapproche des deux autres;
- 4 charges conduiraient au tétraèdre et si une charge se déplace, elle s'éloigne d'une mais se rapproche des deux autres.
On va constater qu'un premier raisonnement consiste à ne
compter que les liaisons σ et les doublets non liants (n) des
atomes pour obtenir leur géométrie. On désigne par A l'atome, X les liaisons σ et E les doublets non liants (on ignore les
liaisons π) on adoptera la symbolisation "AXE".
Les molécules tétraédriques ou dérivées sont les suivantes :
Pour résumer, on peut pratiquer ainsi :
- on écrit la formule VSEPR du composé AXmEn
- si m + n = 2 → linéaire, m + n
= 3 → plan 120° et m + n = 4 → tétraédrique α ≈ 109°
- la forme observée dépend de n
si plan 120° et n
= 1 → molécule coudée α > 120° (SnCl2)
si tétraédrique et n = 1 → pyramide à base triangulaire
α ≈ 107° (NH3)
si tétraédrique et n = 2 → molécule coudée
α ≈ 105° (OH2)
Ce sont les cas les plus simples et les plus courants.
Attention : il y a une confusion courante entre géométrie globale qui se réfère
à l'ensemble des liaisons et des doublets,
comme par exemple tétraédrique pour CH4, NH3 ou H2O et
géométrie de la molécule qui
est respectivement
tétraédrique, pyramide à base triangulaire et
coudée.
En effet, un doublet non liant ne peut être mis en évidence (par exemple par des
méthodes spectrales) dans NH3 ou H2O
par contre, il a une incidence sur la géométrie de la molécule.