L’effet mésomère
On peut présenter l'effet mésomère comme une
description de la répartition des électrons dans les
molécules le plus
souvent organiques. Elles ont généralement une alternance π-σ-π, n-σ-π, v-σ-π ou
n-σ-v (n = non liant et v = vacance
électronique).
Pour aborder cette notion, on utilisera la notion de liaison chimique, le formalisme de Lewis
et la notion
d'électronégativité
des atomes.
La résonance est un concept fondamental dans les modèles des liaisons de valence.
Elle indique que la forme mésomère définie par un schéma de Lewis unique n'est pas toujours
suffisante pour décrire
correctement la répartition électronique.
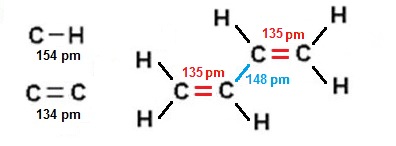
On va présenter cette notion à partir d'un exemple : le butadiène.
Le schéma
de Lewis classique pour cette molécule fait apparaître deux liaisons doubles et
une liaison
simple centrale
carbone-carbone (H2C=CH-CH=CH2).

La longueur de la liaison centrale (148 pm) est plus courte
qu'une liaison simple standard et les
liaisons doubles sont
plus longues (135 pm) que
les liaisons éthyléniques.
Le
renforcement de la liaison centrale et l'affaiblissement
des liaisons doubles ne peuvent être justifiés que par
l'existence
de formes mésomères qui montrent les
déplacements des électrons π dans la molécule.
On qualifie
de "conjuguée"
les liaisons et leur
déplacement
modifie leurs caractéristiques. Le
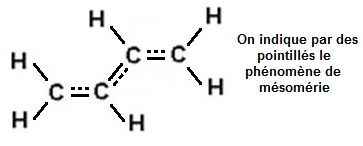
schéma de
résonance
suivant avec 3 formes
mésomères représente la molécule réelle mais il s’agit de formules
limites :
+H2C-CH=CH-CH2- ↔ H2C=CH-CH=CH2
↔ -H2C-CH=CH-CH2+
En mécanique quantique, cela revient à dire que la fonction d'onde est une combinaison linéaire des
deux fonctions
mésomères correspondant à chaque forme mésomère de Lewis.
![]() Par commodité, on se contente souvent d'une seule représentation de
Lewis, notamment lors de l'écriture de mécanismes réactionnels.
Par commodité, on se contente souvent d'une seule représentation de
Lewis, notamment lors de l'écriture de mécanismes réactionnels.
Le chimiste doit cependant toujours avoir à l'esprit l'existence de
l'hybride de résonance lorsqu'il est en présence de structures
conjuguées.
Lorsqu'il est nécessaire de combiner plusieurs formes mésomères, cela indique que l'appariement
des électrons sur
les liaisons n'est pas statique : il est dit résonant.
Un exemple typique de résonance des électrons se trouve dans la molécule de benzène :
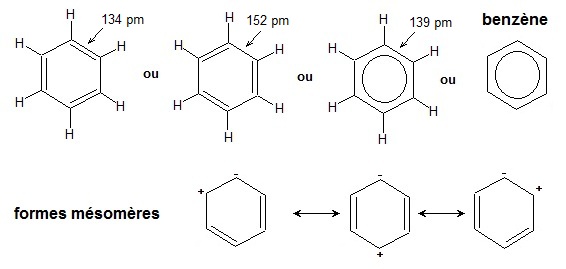
L'hybride de résonance traduit le mélange de formules mésomères limites, il est le symbole graphique
d'une fonction
d'onde qui est la combinaison linéaire des différentes fonctions mésomères limites.
Les formules limites de Lewis sont reliées par une flèche double. Dans l'hybride de résonance, on
illustre la
délocalisation
des liaisons par des traits en pointillés (ou
un cercle pour le benzène).
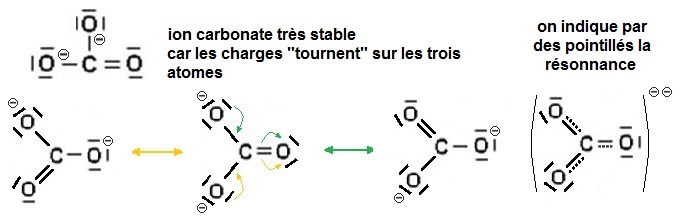
Le phénomène de mésomérie stabilise les ions, par exemple, pour
CO32- , on peut établir plusieurs
formes mésomères
prépondérantes
qui diffèrent par la position des paires libres et des paires liantes :
Pour les systèmes insaturés, on peut considérer que les liaisons axiales (σ) correspondent à un seul
schéma de liaison.
Elles définissent le squelette de la molécule.
La résonance concerne les liaisons latérales (π) qui sont plus mobiles.
Les groupements chimiques ont des effets mésomères :
-
donneurs
+M (-O-, -N-, -Cl, -S-, ...) qui "donnent" un doublet ![]()
qui crée une charge + sur l'atome donneur
- attracteurs -M (-CO-, -CO2H, -COO-, -C≡N, -NO2, ...)
qui "attirent" un doublet
Effet des substituants
Les substituants possèdent en général des effets à la fois inductifs et mésomères qui ont trait aux
électrons σ et π
![]()
qui crée une charge - sur l'atome attracteur
respectivement.
La polarisation globale des liaisons rend compte de la superposition de ces deux effets.
Le moment dipolaire global résulte donc de la polarisation des électrons (effet inductif) et de celle des
électrons délocalisés
(effet mésomère).
Il s'avère qu'en général l'effet mésomère est prépondérant
sauf dans le cas des halogènes.
Atomistique et liaison chimique
La liaison chimique
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr