- l’interaction dipôle permanent-dipôle permanent (Keesom),
- l’interaction dipôle permanent-dipôle induit (Debye),
- l’interaction dipôle induit-dipôle induit (London).
Chacune de ces interactions décroît très rapidement avec la distance entre les deux dipôles suivant des lois en 1 / d6 où
d est la distance entre les deux dipôles. Ainsi cela n’a de sens d’étudier ces interactions que lorsque les molécules sont
au voisinage l’une de l’autre.
Au-delà de quelques longueurs moléculaires, elles sont négligeables devant les autres forces. Par exemple, l’interaction
entre deux particules est divisée par 26 = 64 si la distance entre les particules et multipliée par 2 !
Interaction de Keesom : dipôle permanent-dipôle permanent
Cette interaction existe entre deux molécules polaires, par exemple H-Clgaz. Elle est d’autant plus
grande
que les
moments
dipolaires sont grands et que les molécules sont proches.
Chaque molécule est un dipôle et crée un champ électrique dans son voisinage qui
lui même est
soumis à l'interaction de
tous les autre dipôles des autres molécules H-Cl.
Ces dipôles s'orientent les uns par rapport aux autres et mettent en jeu une
énergie d'interaction (de
Keesom) que l'on
écrit : EK = - kK / r6
où kK est
une constante qui dépend de T et de μ
La différence entre l’état gazeux et l’état liquide s'explique par ce type d'interactions intermoléculaires.
Interaction de Debye : dipôle permanent-dipôle induit
Par exemple, on peut ne expliquer la dissolution des molécules de diiode peu
solubles dans l’eau par
les interactions de
Keesom puisque le diiode est apolaire.
Néanmoins, lorsqu’une molécule est solvatée, elle est entourée de molécules d’eau
qui polarisent la
molécule de diiode.
Les interactions de Debye sont liées à la formation de liaisons intermoléculaires
dipôle
permanent (de l’eau) - dipôle
induit
(du diiode).
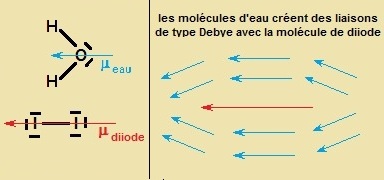
Une molécule polaire crée donc un champ
électrique à son voisinage qui peut polariser
une molécule apolaire voisine. L’énergie
potentielle du système constitué des deux
molécules est une fonction du
moment
dipolaire de la première et de la
polarisabilité
de la seconde. L'équation est du même type
que précédemment : ED = - kD / r
où kD est une constante qui dépend de α et de μ
Interaction de London : dipôles induit-dipôle induit
Les effets précédents n'expliquent ni les écarts des gaz nobles aux lois des gaz
parfaits, ni la stabilité
des édifices de
molécules apolaire de type H
En raison du mouvement incessant des électrons dans une molécule, celle-ci présente à chaque instant un moment
dipolaire instantané non nul, bien que sa moyenne dans le temps soit nulle. Chaque dipôle instantané est en interaction
avec les dipôles instantanés des molécules voisines et polarise instantanément les molécules voisines.
London a proposé : EL = - kL / r
6 où kL est une constante qui dépend de αIntensité relative de ces forces
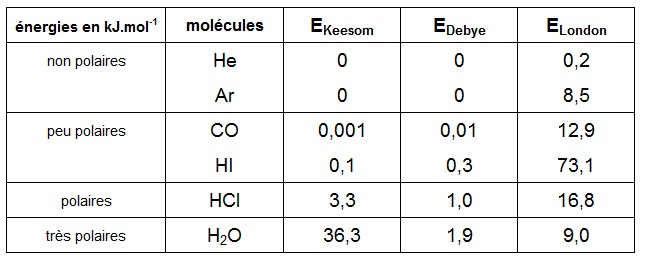
Ces trois types de forces de van der Waals peuvent intervenir de manière
simultanée. Le tableau
suivant regroupe
quelques exemples qui mettent en évidence que les forces de
London
sont la plupart
du temps prépondérantes, même
pour les molécules polaires (à
l'exception de l'eau).
On note que l’énergie de liaison est très faible pour les molécules non polaires
mais elle peut devenir
importante pour les
molécules très polaires (relativement aux énergies de
liaison, quelques centaines de kJ.mol-1).
La somme des trois effets s'écrit : E = - (kK+ kD+ kL) / r
6 = - kvan der Waals / r6L'ordre de grandeur est généralement de 1 à 10 kJ.mol-1 pour l'énergie et 300 à 500 pm pour la distance.