Liaison métallique
La liaison chimique est le phénomène physique qui lie les
atomes entre eux par des forces
électrostatiques.
La liaison métallique, permet la cohésion
des atomes d'un métal.
Elle concerne simultanément un très grand nombre d'atomes (plusieurs millions au moins).
Ces atomes mettent en commun un ou plusieurs électrons, appelés "électrons libres" qui sont
à
l'origine de la conductivité
électrique des métaux.
Contrairement à la liaison covalente, on peut voir les électrons libres comme des électrons
délocalisés
à toute la pièce
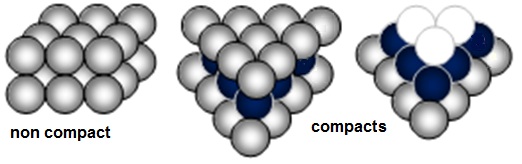
métallique et les atomes sont empilés comme par exemple des
balles de ping-pong.
Ces empilements sont non compacts (52% de vide) ou
compacts (26% de vide). Ces notions seront
développées dans le
module "Chimie du solide".
On peut décrire les niveaux d'énergie des atomes par la théorie des bandes qui
n'est pas présentée
dans ce cours.

Les caractéristiques physiques des métaux tels que la malléabilité, la ductilité, la
conductivité de la
chaleur s'expliquent
par la nature de cette liaison.
Avec l'avènement de la mécanique quantique ce modèle a reçu une interprétation plus formelle
dans
le modèle d'électrons
quasi-libres où les électrons sont considérés comme un gaz voyageant à
travers
la trame du solide.
Atomistique et liaison chimique
La liaison chimique
![]()
Pr Robert Valls
robert.valls@univ-amu.fr