 • par
constituants atomiques (a) :
• par
constituants atomiques (a) :CH4O (formule brute)
La liaison covalente
La liaison chimique est le phénomène physique qui
lie les atomes entre eux en échangeant ou
partageant un ou
plusieurs électrons de sa couche de valence (d'ou son nom :
liaison) ou par des
forces
électrostatiques (ou interactions)
qui par exemple lient les molécules entre elles.
On devrait
donc dire
la liaison physique (d'ailleurs ce sont des physiciens qui
ont
fait avancer le concept de liaison) est un
phénomène
chimique puisqu'elle permet de comprendre les réactions chimiques
où justement
interviennent leur
rupture et leur création.
Ces liaisons chimiques peuvent être divisées en différents
types : covalentes, ioniques, métalliques et
faibles. Leur simple
nom évoque déjà des notions et les liaisons covalentes et
ioniques sont des
liaisons
fortes qui conduisent bien à
lier des atomes. Les liaisons faibles sont
différentes et on
utilise
souvent les termes forces ou interactions car elles
différent des
précédentes
et aboutissent à lier non
pas des atomes mais des molécules entre elles. La
liaison métallique
lie des
atomes mais ce sont des
liaisons de type van der Waals qui interviennent. Il
faut préciser tous ces
éléments point
par point.
Un premier type, la liaison covalente,
peut être décrit de manière simplifiée par une paire d'électrons
située
principalement dans
l'espace se trouvant entre deux noyaux atomiques où ils sont soumis à
l'influence de ces deux noyaux.
Parallèlement, les électrons présents entre les
noyaux empêchent leur
répulsion et de plus, ils les attirent et les amènent à
se rapprocher au
lieu de se repousser.
Cette situation tend à maintenir le noyau et les
électrons dans une configuration
stable bien qu'ils
soient libres de se
mouvoir en accord
avec les contraintes de la mécanique
quantique.
La liaison est fortement directionnelle et localisée aussi les
molécules, liées par des liaisons
de covalence tendent à
adopter des géométries caractéristiques
possédant des angles de liaison
spécifiques.
Le modèle des liaisons de valence a été complété
par le modèle des orbitales moléculaires qui
propose, lorsque les
atomes se rapprochent,
que leurs orbitales atomiques interagissent et forment
un ensemble d'orbitales moléculaires
qui s'étend sur
toute la molécule.
La moitié de ces orbitales tend à être des orbitales liantes et l'autre moitié
anti-liantes ou non liantes.
Comme les atomes, les molécules et leurs orbitales sont tous tridimensionnels, il est difficile d'utiliser
des
techniques
simples pour les représenter. Dans les formules moléculaires, la liaison chimique
(orbitale
liante) entre deux atomes est
indiquée de différentes manières selon les nécessités
et
parfois, elle
est totalement ignorée.
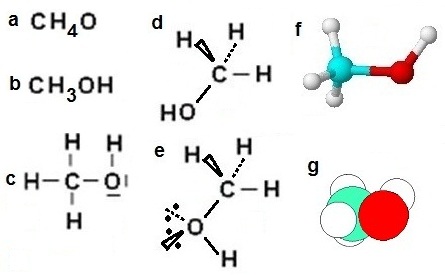
Selon la nécessité, la formule moléculaire du méthanol peut être écrite sur le papier :
 • par
constituants atomiques (a) :
• par
constituants atomiques (a) :
CH4O (formule brute)
•
en séparant le groupe fonctionnel
CH3OH du reste de la molécule (b)
• en formule développée (c) :
représentation de Lewis
• selon la configuration (e et f)
• en trois dimensions (d, f et g) :
on peut même indiquer le doublet
non-liant et
sa géométrie (e)
Ces liaisons peuvent être simples, doubles ou triples c'est-à-dire
que le nombre d'électrons contenus
dans les orbitales de
liaison est de deux, quatre ou
six.
Il existe des cas particuliers comme les atomes de carbone dans le benzène qui sont liés
l'un à l'autre
par environ
1,5
liaisons, ce que confirment l'énergie de liaison
et la distance entre les atomes et il en
découle des représentations
adaptées de ces molécules aromatiques.
Des liaisons quadruples entre atomes ne sont pas impossibles mais sont très rares.
Les exercices sont proposés dans la
partie suivante "Géométrie des molécules"
car certaines notions sont nécessaires pour pouvoir proposer
des géométries de molécules. Il faut donc bien assimiler cette partie du cours
qui est riche en savoirs pour l'utiliser par la suite.
Atomistique et liaison chimique
La liaison chimique
![]()
Pr Robert Valls
robert.valls@univ-amu.fr