Diagrammes des niveaux d’énergie dans les molécules diatomiques
Le fonctionnement du cortège électronique de l’atome est connu à travers les
orbitales atomiques (OA) et il va aider à
comprendre celui
des molécules à travers les orbitales moléculaires
(OM).
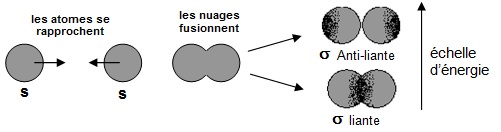
La molécule de dihydrogène, dans laquelle il y a deux noyaux et deux électrons, peut être décrite de la façon suivante :
- les électrons se disposent de manière à minimiser l’énergie totale
- une orbitale ne peut être occupée que par deux électrons (spins opposés)
- les volumes occupés par les électrons 1s de chaque atome fusionnent et la probabilité de présence
la
plus grande se
situe entre les deux atomes.

Dans la molécule de dihydrogène, l’O.M. liante (liaison σ) présente un axe de symétrie qui joint les
deux noyaux.
Elle est le résultat de l’addition de deux O.A. (1s) de symétrie sphérique.
L’O.M. anti-liante (σ*) est inoccupée et présente une symétrie du même type.
Du point de vue énergétique le système obéit à la séquence : énergie σ1s < énergie 1s des deux atomes < énergie σ*1s.
On utilise une représentation pour les énergies des orbitales :
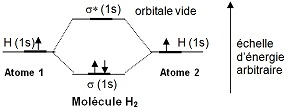 |
Il s’est formé une orbitale liante (σ) et une orbitale anti-liante (σ*) qui est vide. L'orbitale liante représente la liaison σ qui existe entre les deux atomes. Mathématiquement, on cherche le lieu de présence des électrons dans la molécule (leur orbitale moléculaire) et on considère qu'il s'agit d'une combinaison linéaire des deux orbitales atomiques. |
C’est la méthode L.C.A.O. : 2 orbitales atomiques (OA) → combinaison linéaire → 2 orbitales moléculaires (OM).
Prenons l'exemple de la molécule de diazote : les électrons de la couche 1s ne
participent pas à la
liaison des deux
atomes. En effet, les électrons de la deuxième
couche empêchent que les atomes
se rapprochent suffisamment pour que
les
orbitales 1s puissent se recouvrir.
Seule la couche 2 dite couche de valence intervient dans la liaison chimique.
Comme les niveaux 2s et 2p sont énergétiquement éloignés, on peut les traiter séparément :
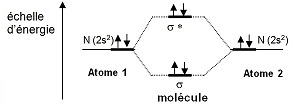 |
Les OA 2s donnent en se combinant deux OM : liante σ et anti-liante σ* selon un schéma ci-contre. Les électrons 2p3 vont participer à la liaison, mais il s’agit d’orbitales p dont le recouvrement est différent de celui des orbitales s. |
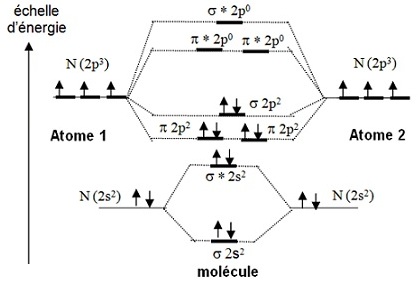 |
On constate que la
liaison entre les deux atomes est
Pour être complet, on peut ajouter les
doublets σ2s
Mais cette présentation ne tient pas compte des |
Ce modèle plus complexe que les propositions de Lewis est nécessaire pour
expliquer certaines
propriétés des
molécules et en particulier les propriétés
magnétiques que l'on verra dans les
exercices après le paragraphe suivant
sur les indices de liaison.
Les exercices sont proposés dans la
partie suivante "Indice de liaison",
il faut donc bien assimiler cette partie du cours
qui est riche en savoirs
pour l'utiliser par la suite.
Atomistique et liaison chimique
La liaison chimique
![]()
Pr Robert Valls
robert.valls@univ-amu.fr