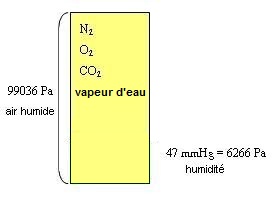
47 mmHg = 101325 x 47 / 760 = 6266 Pa
La pression atmosphérique lors d'un temps pluvieux est de 99036 Pa
avec 6266 Pa d'humidité (vapeur d'eau) que l'on peut
diviser en "humidité" et
"air sec".
cliquer sur la figure pour revenir à l'original

La partie jaune représente l'air sec dont la somme de toutes les pressions
partielles est de
99036 - 6266 =
92770 Pa
En vert, l'humidité représente 6266, donc la somme des pressions partielles de tous les gaz est de :
92770 + 6266 = 99036 Pa qui est bien la pression totale.
Or les fractions molaires de l'air sec ont été calculées à la question précédente
et peuvent être
utilisées avec leur pression de 92770 Pa :
0,7904 x 92770 = 73325 Pa de N2
0,2093 x 92770 = 19417 Pa de O2
0,0003 x 92770 = 28 Pa de CO2
On peut vérifier que la somme des pressions partielles est égale à 99036 Pa :
6266 (humidité) + 73325 (N2) + 19417 (O2)+ 28 (CO2) = 99036 Pa
Et l'on peut calculer les fractions molaires de l'air humide :
6266 / 99036 = 0,0633 pour H2O
73325 / 99036 = 0,7404 pour N2....................
on note que les trois dernières fractions molaires
19417 / 99036 = 0,1960 pour O2....................
ont diminué du fait de la présence de l'humidité
28/ 99036 = 0,0003 pour CO2
La somme des fractions molaires est bien égale à 1.
Quand il fait beau on dispose d'une pression partielle d'oxygène de 21207 Pa
pour 19417 quand
il fait mauvais temps.
Soit environ (21207 - 19417) / 21207
≈
9% d'oxygène en moins par inspiration !
On respire donc 9% plus vite ce qui nous rends moins sereins les jours de pluie.
Pensez à revenir à la page
"Savoirs et savoir faire"
pour vérifier vos acquisitions.
Thermodynamique et cinétique
Pressions partielles et gaz parfaits Enoncé
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr