| Leu (s) | Gly (s) | Leu-Gly (s) | H2O (l) | |
| ΔS298 K (en J.K-1) | .+ 207 | + 122 | + 281 | + 70 |
| ΔH298 K (en kJ) . | - 644 | - 529 | - 866 | - 286 |

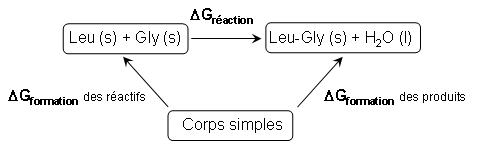
ΔGréaction = [(ΔHLeu-Gly - TΔSLeu-Gly) + (ΔHH2O - TΔSH2O)] - [(ΔHLeu - TΔSLeu) + (ΔHGly - TΔSGly)]
= [(- 866000) - 298 x (+ 281) + (- 286000) - 298 x (+ 70)] - [(- 644000) - 298 x
(+ 207) + (- 529000)
- 298 x (+ 122)] = + 14444 J = + 14,4 kJ
C'est donc une réaction endergonique impossible spontanément.
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.