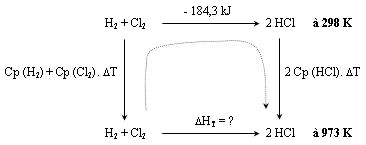
On donne : CpH2 = 30,5 J.mol-1.K-1 ; CpCl2 = 36,8 J.mol-1.K-1 ; CpHCl = 31,5 J.mol-1.K-1.
On souhaite donc calculer ΔH700°C à partir de ΔH
25°C ( ou ΔH0).
On construit un cycle comme décrit dans "Caractéristiques de
l'enthalpie" :

ΔH973 K = - [(30,5 + 36,8) . 675] + (- 184300) + [31,5 . 675 . 2] = - 187,2 kJ
Pour plus de détails voir la
correction proposée dans "Caractéristiques de
l'enthalpie".
Pensez à revenir à la page "Savoirs et savoir faire"
pour vérifier vos acquisitions.