DUT Chimie 11CG1
Correction de l'exercice : Énergie Enthalpie -
Définir ...
A 25° C, on propose à pression atmosphérique, la réaction suivante :
H2 (g) + Cl2 (g) → 2 HCl (g)...........................
ΔH25°C = - 184,3 kJ
A pression atmosphérique, calculer ΔH700°C.
On donne : CpH2 = 30,5 J.mol-1.K-1 ;
CpCl2 = 36,8 J.mol-1.K-1 ; CpHCl
= 31,5 J.mol-1.K-1.
On construit un cycle comme décrit
précédemment :
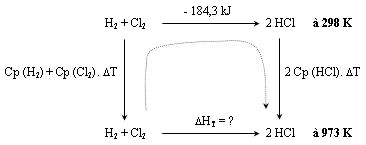
La réaction à 25°C (298 K) a une enthalpie de - 184,3 kJ.
On cherche l'enthalpie à 700°C (973 K) soit un ΔT de 675°C ou K (c'est
indifférent pour les ΔT).
ΔH973 K = - [(30,5 + 36,8) x 675] + (- 184300) + [31,5 x 675 x 2] =
- 187,2 kJ
L'enthalpie à 25 °C est augmentée de la chaleur nécessaire pour réchauffer les
produits de 675 °C
et diminuée de la chaleur nécessaire pour réchauffer les réactifs de 675 °C.
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.
Module 11CG1
Energie interne - Enthalpie
Variation de l'enthalpie
Enoncé
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-cezanne.fr

