Loi de Hess : La chaleur de réaction à volume ou pression constante ne dépend ni du nombre
ni de la nature des étapes
intermédiaires.
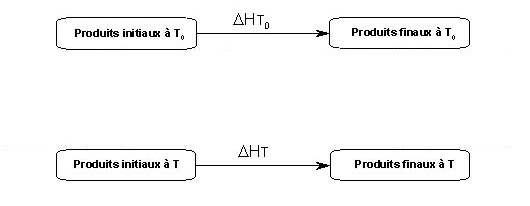
Calcul d’enthalpies en fonction de la température (cycle à 4 étapes) :
Pour aller des produits initiaux à T aux
produits finaux à T, il y a
deux possibilités
(chemin rouge et chemin noir)
puisque
la loi de Hess nous apprend
que le chemin
suivi est indifférent et
il faut que toutes les
flèches correspondent à des
grandeurs du
même type (ici il s'agit
d'enthalpies ΔH).
Réchauffer
des composés à pression
constante correspond à QP
et on sait que
QP = ΔH (voir les définitions de l'enthalpie).
1°- la flèche correspondant à Σi Cpi.ΔT est prise à contre-sens, on attribue le signe négatif alors ΔHT = - Σi Cpi.ΔT + ...
2°- la flèche correspondant à ΔHT0 est prise dans le même sens, alors ΔHT = - Σi Cpi.ΔT + ΔHT0 + ...
3°- la flèche correspondant à Σf Cpf.ΔT est prise dans le même sens, alors ΔHT = - Σi Cpi. ΔT + ΔHT0 + Σf Cpf. ΔT
ou plus simplement : ΔHT = ΔHT0 + (Σf Cpf - Σi Cpi).ΔT
On peut traduire cette expression en disant que l'enthalpie est augmentée de la quantité de chaleur
nécessaire pour
réchauffer les produits et diminuée de celle nécessaire pour réchauffer les
réactifs.
|
|
T |
|
|
Si Cp est une fonction de T, l'expression devient : |
ΔHT = ΔHT0 + ʃ |
(Cpf - Cpi) dT |
|
|
T0 |
A retenir :
La loi de Hess et la relation entre l'enthalpie à T0 et l'enthalpie à T.