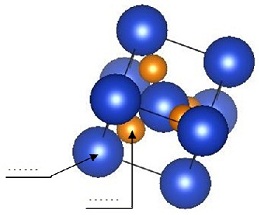
b- Connaissant les rayons des petits ions Rpetit = 88 pm et du paramètre de maille
a = 526,5 pm, calculer les rayons des grands ions Rgrand.
c- Déterminer la distance entre les ions Cu+ / Cu+, Cu+ / O- -, O- - / O- -.
d- Déterminer l’espace entre les ions Cu+ / Cu+, Cu+ / O- -, O- - / O- -.
e- Donner la coordinance O / O , Cu+ / Cu+, Cu+ / O-.