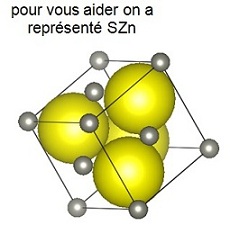
b- Calculer le rapport R+ / R- et justifier une structure de type ZnS.
c- Représenter la maille élémentaire ZnS, compter les ions Cu+ et I- dans la maille et donner Z.
d- Calculer ou donner les distances Cu / I, Cu / Cu et I / I et les espaces correspondants.
e- Pour les composés NaI et CsI, calculer le rapport R+ / R- et proposer un cristal type.
On donne les rayons ioniques de Na+ (95) et Cs+ (169).
f- Dans les deux cas, la valeur des paramètres de maille a’ et a’’.