CONSTRUCTION DE LA CLASSIFICATION PÉRIODIQUE
Définir ...
Énergie d'ionisation
Le potentiel d'ionisation I1 est l'énergie qu'il convient de fournir à un atome gazeux pour lui arracher un électron :
(l'atome) X(gaz)
→ (l'ion) X+(gaz) + 1e
I1 correspond au potentiel de première ionisation. Il existe, un potentiel de deuxième ionisation si on
extrait un second
électron, etc …
I1 augmente en traversant une période (de gauche à droite) et diminue en descendant une famille (de haut en bas).
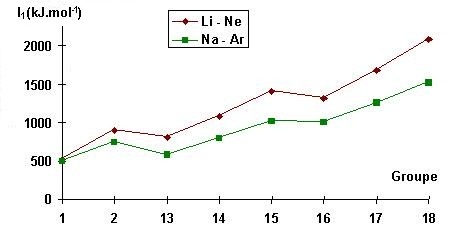 |
Plus l'atome est gros plus l'électron périphérique est éloigné et donc moins il est attiré par le noyau de l'atome.
Il sera en revanche coûteux en énergie, d'ioniser les atomes des éléments chimiques de la colonne des halogènes ou, a plus forte raison, de celle des gaz rares.
On retrouve alors un diagramme d’énergie de première ionisation en fonction de Z qui est en dents de scie.
|
Une vue de l'ensemble des éléments permet de visualiser les différentes évolutions relatives.
Les gaz rares présentent les plus fortes valeurs puisqu'ils ont une couche saturées stable, viennent ensuite les halogènes
qui n'aspirent qu'à prendre un électron pour donner l'ion X- et qui n'en perdront pas facilement un.
L'hydrogène présente une valeur relativement importante mais si l'on le
place près du carbone (couche semi pleine), sa
valeur est proche de celle de ses voisins.
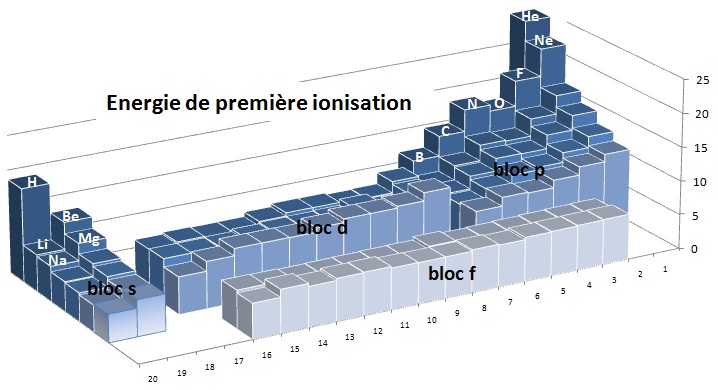
On note que la famille du Bore (13) et celle de l'oxygène (16) présentent la
diminution décrite sur la première figure.
 Conseil : un résumé proposé dans "
Mémoriser", mais il est préférable de bien apprendre cette partie qui est riche en savoirs, le résumé
Conseil : un résumé proposé dans "
Mémoriser", mais il est préférable de bien apprendre cette partie qui est riche en savoirs, le résumé
étant la trame à partir de laquelle on retrouve l'ensemble du cours.

