
a- Positionner correctement les mots : pression, température, volume, solide, liquide, vapeur et
supercritique.
b- préciser les limites de la zone supercritique.
c- Que représente le point C ?
Que représente la zone plus foncée contenant le point C ?
Que représente la courbe en pointillés serrés ?
Que représente la courbe en grands pointillés ?
d- Caractériser par une phrase : les solides, les liquide et les gaz.
e- Le passage de l'état liquide à l'état gazeux s'accompagne de changement importants de quels
paramètres.
Donner des ordre de grandeur de ces variations.
f- Commenter l'état plasma en quelques phrase.
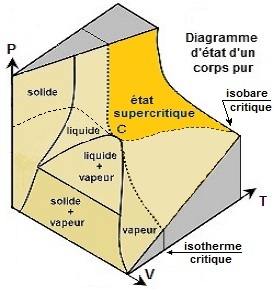 La zone supercritique est limitée par deux courbes :
La zone supercritique est limitée par deux courbes :
- L'isotherme critique en traits pointillés serrés
- L'isobare critique en grands pointillés
Le point C étant le point à partir duquel on ne peut liquéfier un gaz par simple
compression.
La zone plus foncée contenant le point C défini la zone dans laquelle on ne peut
liquéfier un gaz par simple compression.
Dans cette zone, le corps est gazeux ou supercritique.
L'état solide est un des états de la matière caractérisé par l'absence de liberté
entre des atomes de métal, entre des molécules (sucre) ou entre des ions (sel).
La plupart des solides sont des cristaux et le modèle du cristal permet de se
faire une bonne idée de l'état solide :
les atomes sont disposés dans l'espace de manière régulière et ordonnée.
Les critères macroscopiques de la matière à l'état solide sont : une forme propre et un volume propre.
Les solides sont caractérisés par un agencement des atomes très ordonnés et rapprochés ils ont donc une faible
dilatation et il est très difficile de les comprimer car il y a peu d’espace entre les atomes. De plus, tous les atomes sont
fortement liés les uns aux autres, ce qui confère aux solides une forme propre bien délimitée dans l’espace.
Il ne faut pas considérer le solide comme un état figé de la matière car avec la température, les atomes vibrent autour de
leur position d'équilibre et si la température est suffisante, ils fondent et passent à l'état liquide et même gazeux.
Le liquide est une forme de fluide où les molécules sont faiblement liées, ce qui rend les liquides parfaitement
déformables.
Mais, à l'inverse du gaz, elles sont tout de même liées et une molécule ne peut s'éloigner beaucoup d'une autre, ce qui
fait que la matière liquide a une cohésion que ne possède pas le gaz (et comme dans les solides, les molécules sont
très proches les unes des autres, cela rend les liquides difficilement compressibles).
Au niveau microscopique, on décrit un gaz comme un ensemble d'atomes ou de molécules très faiblement liés et quasi
indépendants.
D'un point de vue macroscopique, on caractérise la matière à l'état gazeux par les critères suivants :
un gaz n'a pas de forme propre,
il n'a pas de volume propre,
il tend à occuper tout le volume disponible.
Tout corps pur peut se trouver sous trois états (aussi appelés phases) : solide, liquide ou gazeux.
La masse volumique d'un corps pur atteint son minimum à l'état gazeux.
Elle décroît sous l'effet d'une baisse de pression ou d'une hausse de la température (on parle de dilatation des gaz).
Les mouvements aléatoires des atomes ou molécules qui composent le gaz le rendent informe et lui permettent d'occuper
entièrement l'espace clos qui le contient.
En physique, le plasma décrit un des états de la matière (autre que solide, liquide, gaz ou supercritique). C'est un milieu
constitué de particules neutres, d'ions et d'électrons.
Lorsqu'on chauffe un gaz suffisamment, les électrons des couches extérieures peuvent être arrachés lors des collisions
entre particules, ce qui forme le plasma. Globalement neutre, la présence de particules chargées donne naissance à
des comportements inexistants dans les fluides, en présence d'un champ électromagnétique par exemple.
Un plasma peut également se former à basse température si la source d'ionisation lui est extérieure.
C'est le cas de l'ionosphère qui subit en permanence un intense bombardement ionisant de particules venant du soleil.
Les aurores polaires sont l'une des manifestations de ce plasma.
Cet état est le plus représenté dans l'univers, dans les étoiles, le milieu interstellaire et aussi l'ionosphère terrestre (99%).
À une autre échelle, on trouve également des plasmas dans les tubes fluorescents (les tubes néons), les propulseurs
spatiaux et ils sont couramment utilisés dans l'industrie notamment en micro-électronique.
Les plasmas sont très répandus dans l’univers (étoiles, quasars, pulsars) mais sont également présents dans des
phénomènes naturels terrestres comme les aurores boréales ou plus simplement les éclairs. Dans les applications
domestiques, certains téléviseurs plats (écrans plasmas) utilisent cet état de la matière.