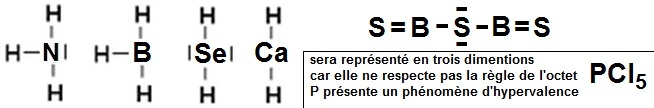

b- Dans la nomenclature AXmEn les molécules s'écrivent, dans l'ordre :
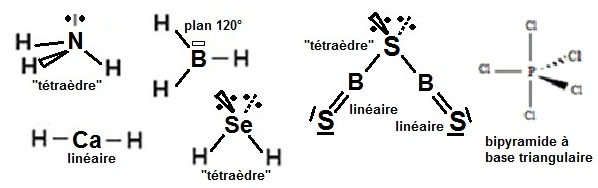
AX3E = 4 directions = tétraèdre (une direction non visible)
AX3 = 3 directions = plan 120°
AX2E2 = 4 directions = tétraèdre (deux directions non visibles)
AX2 = 2 directions = linéaire
Pour B = AX2 = linéaire
pour S central = AX2E2 = tétraèdre (deux directions non visible)
AX5 = 5 directions = bipyramide à base triangulaire
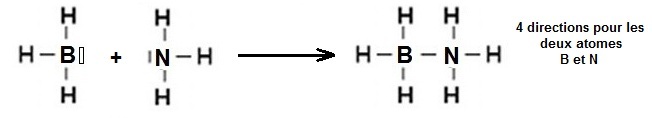
c- La molécule H3B possède une lacune électronique (il lui manque deux électrons pour satisfaire
la règle de l'octet) et INH3
possède un double non liant, il s'établit une liaison de coordinance entre les deux.
La géométrie de la molécule H3B-NH3
est obtenu à partir de la représentation de Lewis :
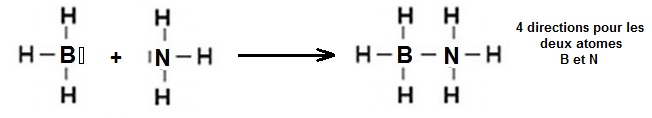
La molécule est constituée de deux tétraèdres et elle est comparable à la molécule d'éthane.
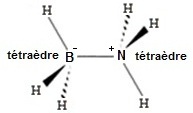 La molécule obtenue est globalement neutre mais le Bore satisfait la
La molécule obtenue est globalement neutre mais le Bore satisfait la
règle de l'octet après la formation de la molécule puisque l'Azote fournit
les deux doublets de liaison. La création de cette liaison de coordinance
confère à l'atome de Bore une charge - et parallèlement l'Azote présente
une charge +.
C'est donc une molécule particulière mais sa géométrie est classique.
d- La formation l'ions AlCl4- est comparable à la réaction précédente puisque AlCl3
présente une lacune et Cl- un doublet
non liant (ici le doublet non liant appartient à un ion au lieu d'une molécule précédemment).
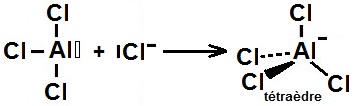 La charge négative transfère vers l'atome
La charge négative transfère vers l'atome
d'aluminium puisque tous les Chlore respectent
la règle de l'octet l'ion Chlore devient un atome
de Chlore simplement lié dans une molécule.
L'atome d'aluminium récupère donc un électron
supplémentaire qui lui donne une charge -.