THERMOCHIMIE
PREVISION DES REACTIONS
Application du premier principe à la détermination des chaleurs de réaction
Détermination indirecte des chaleurs (énergies) de réaction
Méthode du cycle ou méthode de Hess
Les chaleurs de réaction sont les variations d'enthalpie ou d'énergie interne selon que la réaction s'effectue à pression constante ou à volume constant.
La méthode de Hess est basée sur l'utilisation des tables de données thermodynamiques où sont compilées les variations d'enthalpie standards (D H°f) et les variations d'énergie interne standards (D U°f) de formation des composés à partir des éléments.
NB Il est bien évident que les chaleurs standards de formation des éléments à partir des éléments eux mêmes sont nulles (état final = état initial).
Cependant, certains éléments sont, dans l'état standard, sous forme de combinaisons chimiques simples encore appelées corps simples.
Exemple: O2 , N2 , H2 , Cl2 ,.....
Par convention, les chaleurs standards de formation de ces corps simples sont nulles.
Ainsi, D H°f (D U°f) O2 = D H°f (D U°f) N2 = .......... = 0
Principe de la méthode
H et U sont des fonctions d'état. Leurs variations ne dépend donc que des états initial et final, quels que soient les chemins réactionnels empruntés pour passer de l'un à l'autre et qui peuvent même être fictifs.
NB On ne traitera ici que les réactions s'effectuant à pression constante (souvent la pression atmosphérique). Pour celles s'effectuant à volume constant, il suffira de remplacer D H par D U.
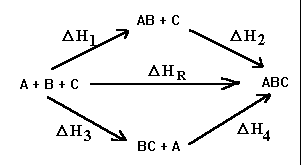
Soit une réaction générale:
D HR
A + B + C ® ABC
On peut envisager plusieurs chemins réactionnels:

Les états initial et final étant les mêmes, on peut écrire:
D HR = D H1 + D H2 = D H3 + D H4
Exemple d'application
Calculer la chaleur de réaction standard de la réaction d'hydrogénation, en phase gaz de l'éthylène en éthane.
C2H4 + H2 ® C2H6
On trouve dans les tables de données thermodynamiques:
D H°f (C2H4 ) = 12, 6 Kcal . mol-1
D H°f (C2H6 ) = - 20, 2 Kcal . mol-1
On peut envisager le cycle suivant:
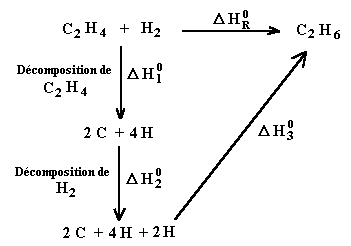
Le cycle permet d'écrire: D H°R = D H°1 + D H°2 + D H°3
NB Les variations d'enthalpie standard de décomposition sont, au signe près, celles de formation. Ainsi, on a:
D H°1 = - D H°f C2H4
D H°2 = - D H°f H2
On obtient finalement: D H°R = (- D H°f ( C2H4 )) + ( - D H°f ( H2 )) + D H°f ( C2H6)
réactif réactif produit
D H°R = (- 12, 6) +(0) + (- 20, 2) = - 32, 8 Kcal
Rappel: D H°f (H2) = 0 puisqu'il s'agit d'un corps simple.
NB Le signe - indique que la chaleur est perdue par le système. C'est donc une réaction exothermique.
Généralisation
On considère maintenant une réaction générale:
Les valeurs des D H°f que l'on trouve dans les tables de données thermodynamiques correspondent à une mole de composé (cal . mol-1). Il faut donc prendre en compte les coefficients stœchiométriques de la réaction, soit:
On a ainsi deux lois de Hess selon que la réaction s'effectue à pression constante ou à volume constant: