| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

ÉTUDE DES GRANDES FAMILLES DE COMPOSÉS INORGANIQUES
Connaissances ... définir ... La structuration de la classification ...
Mendeleïev dispose les éléments par masse atomique croissante et observe une périodicité de leurs propriétés.
Il décide donc de rassembler dans une même famille les éléments possédant des propriétés chimiques semblables et définit ainsi les bases
de la classification actuelle en familles et périodes.
cliquer sur la figure pour retrouver l'état initial |
De nos jours, les éléments sont classés par numéro atomique croissant (Z = nombre de protons dans le noyau). Des lignes horizontales sont appelées périodes et correspondent aux sous couches électroniques en tenant compte de leur ordre de remplissage et à partir de la période 4 on observe un croisement des niveaux. Des colonnes verticales correspondent à des familles chimiques avec des |
et les relations diagonales peuvent perturber les familles (elles seront détaillées par la suite).
Pour mémoriser les premières lignes de la classification, il est proposé deux
phrases :
- Lili Bêla Bien Chez Notre Oncle François-Nestor
- Napoléon Mange Allègrement Six Poulets Sans Claquer d'Argent
H et He se placent respectivement au sommet de la colonne 1 et au sommet de la colonne 18.
Des symboles sont utilisés dans la classification et il est bon de les connaître et de les positionner rapidement :
- les lignes ou périodes sont numérotées de 1 à 7 ou (K à Q)
- les colonnes sont numérotées de 1 à 18 (le bloc f est placé sous la classification)
- les colonnes sont identifiées par des chiffres de 1 à 18 qui peuvent être globalement associés aux états d'oxydation des éléments :
• 1 et 11 ont un seul électron dans la sous couche s et donnent l'ion M+
• 2 et 12 ont deux électrons dans la sous couche s et donnent l'ion M2+
• 3 et 13 ont trois électrons dans les dernières sous couches s et p et donnent l'ion M3+
• 4 et 14 (seulement les métaux) ont quatre électrons dans les dernières sous couches s et p et peuvent donner
l'état d'oxydation +IV
• 5 et 15 (seulement les métaux) ont cinq électrons dans les dernières sous couches s et p et peuvent donner
l'état d'oxydation +V
• 6 à 8 peuvent donner les états d'oxydation +VI à +VIII
• 15 à 17 il leur manque respectivement 3, 2 et 1 électron pour saturer les couche de valence et donnent les ions X3-,
X2- et X-
Remarque : Il existe trois manières de numéroter les groupes dans le tableau périodique,
l'actuelle utilisant des chiffres arabes (1 à 18) et
deux autres anciennes utilisant des chiffres romains (utilisées en Europe ou aux États-Unis). Les numérotations par nombres romains est historique et
remplacée actuellement par des nombres arabes (recommandée par l'Union Internationale de Chimie Pure et Appliquée - IUPAC).
En Europe, la lettre A était utilisée pour la partie droite et la lettre B pour la partie gauche, alors qu'aux États-Unis la lettre A étaient utilisée pour les
éléments du groupe principal et B pour les éléments de transition.
Les groupes de la table périodique sont proposés avec la numérotation
recommandée et la vieille numérotation américaine :
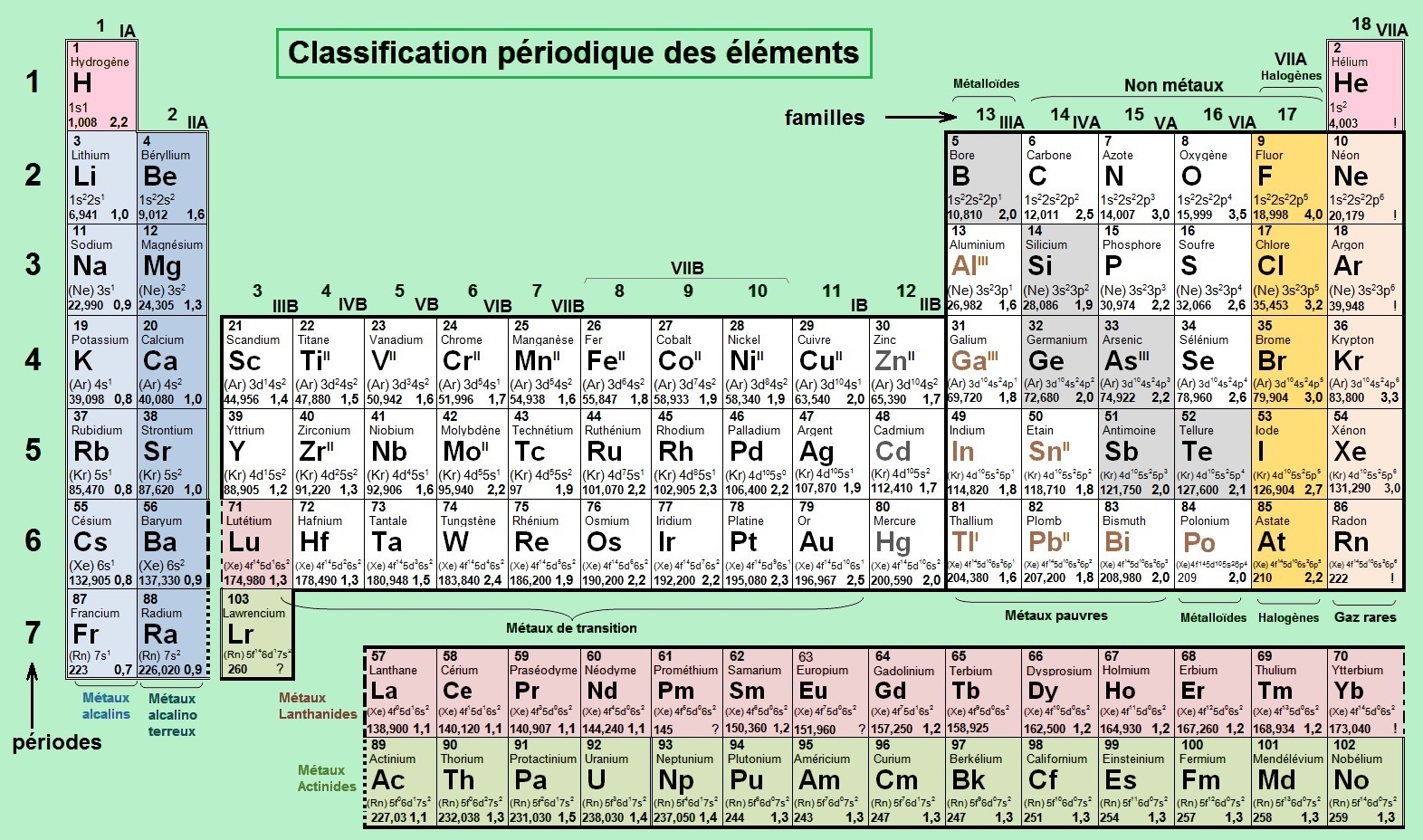 |
Ces anciennes normes permettent d'associer plus facilement les familles chimiques et tout particulièrement pour : • les colonne 11 et 12
• les colonnes 13, 14 et 15
Dans la suite, |
| Pr Robert Valls | robert.valls@univ-amu.fr |