| Ressource d'IUT en ligne | Chimie Inorganique descriptive |

Je consulte
des ressources
sur iut en ligne

STRUCTURE ÉLECTRONIQUE DES ATOMES
Connaissances ... définir ... Les différents principes de répartition des électrons ...
Le principe de stabilité
Les électrons vont se placer le plus près possible du noyau (principe d'Aufbau)
et en commençant par les orbitales de plus basse énergie, on obtient alors une stabilité maximale (on dit
que l'atome est dans son état fondamental).
Comme toute règle, elle présente des exceptions qui seront détaillées par la suite.
La règle de Klechkowski
Les niveaux d'énergie sont peuplés par énergie croissante, cette énergie est généralement une fonction de
la somme (n + l).
Si deux orbitales atomiques présentent la même somme (n + l), c'est l'orbitale atomique possédant la plus petite valeur de n
qui présente l'énergie la plus faible.
|
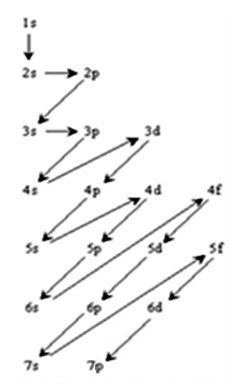
Pour retenir l'ordre de remplissage, il est commode d'utiliser la méthode proposée parKlechkowski* qui correspond au schéma représenté ci-contre. Plusieurs présentations sontpossibles mais celle-ci me paraît simple à mémoriser car on place un niveau par ligne enindiquant, dans l'ordre, les sous couches (on n'indique pas les sous couches qui ne sont pas dans laclassification comme 5g, 6f, ...).
Klechkowski propose de
parcourir les sous couches par
n + l croissant (à somme égale oncommence
par n le plus petit). Bien entendu, il y a des exceptions à cette règle mais elles peuvent souvent être expliquées par l'intervention d'autres phénomènes. Attention, on écrit la structure électronique des éléments dans l’ordre croissant de n et l'on indique 0 pour les niveaux vides, s’ils n’ont aucune utilité, on peut ne pas indiquer ces niveaux vides : La = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 (4f0) 5s2 5p6 5d1 6s2 Dans l’ordre les deux premières exceptions sont : le chrome et le cuivre ensuite le groupe d présente une série d’exceptions qui seront détaillées lors de son étude. |
 cliquer sur la figure pour retrouver l'état initial |
||||||||||||||||||||||||||||||||||||||
|
L’ordre de remplissage selon Klechkowski est donné ci-dessous (voir sur "iutenligne" la ressource Atomistique et liaison chimique) mais il est beaucoup plus facile de le retrouver à partir du schéma proposé au-dessus, à gauche :
on observe bien l'ordre croissant de n lorsque la somme n + l est identique, par exemple, pour n + l = 7 c'est bien le niveau 4 puis 5, 6 et 7 qui se remplissent. Dans les exercices, il sera proposé d'autres astuces pour retenir facilement ce schéma. |
|||||||||||||||||||||||||||||||||||||||
Principe d’exclusion de Pauli
Dans un atome, deux électrons ne peuvent avoir les quatre mêmes nombres quantiques.
Sur une orbitale, symbolisée par une case quantique ![]() il y aura donc deux
électrons de spin opposé symbolisés par des flèches
il y aura donc deux
électrons de spin opposé symbolisés par des flèches
de sens contraire.
La règle de Hund
Les électrons occupent un maximum d'orbitales de même énergie définies par le nombre quantique azimutal l
![]()
avant de les compléter par un deuxième électron de spin opposé
 (voir les nombres quantiques).
(voir les nombres quantiques).
*en français et en allemand avec un "i", Vsevolod Klechkowski prend un "y" en anglais.
| Pr Robert Valls | robert.valls@univ-amu.fr |