Les règles de remplissage des couches électroniques de l’atome
Principe de stabilité (Principe d'Aufbau) : les électrons vont se placer le plus près possible du noyau (dans les orbitales
de plus basse énergie), on obtient une stabilité maximale (état fondamental).
Principe d’exclusion de Pauli : dans un atome, deux électrons ne peuvent avoir les mêmes nombres quantiques.
La règle de Hund : Les électrons occupent un maximum d'orbitales définies par le nombre quantique azimutal l avant
de les compléter par un deuxième électron de spin opposé.
La règle de Klechkowsky :
Les niveaux d'énergie sont peuplés par ordre d'énergie croissante.
Cette énergie est une fonction croissante de la somme (n + l).
Si deux orbitales atomiques présentent la même somme (n + l),
c'est l'orbitale atomique possédant la plus petite valeur de n qui
présente l'énergie la plus faible.
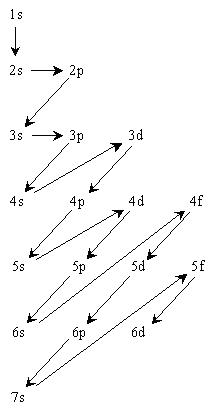
La règle de Klechkowsky peut être illustrée par un schéma qui permet
de retrouver rapidement et sans risque d'erreur l'ordre de remplissage.
Ordre de remplissage :
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
On observe un croisement des niveaux à partir du troisième
puisque
l'orbitale 4s se rempli avant l'orbitale 3d.
Pour bien comprendre ce schéma, on
trace
une diagonale et l'on
constate que la somme n +l est égale au plus grand n (ici 5).
Pour la diagonale choisie on lit 5s, 4p et 3d dont la somme
n + l = 5 + 0 = 5 pour 5s
n + l = 4 + 1 = 5 pour 4p
et n + l = 3 + 2 = 5 pour 3d.
On remplie donc l'orbitale de n plus petit en premier, soit 3d puis 4p et 5s.
Ce raisonnement s'applique à toutes les diagonales.