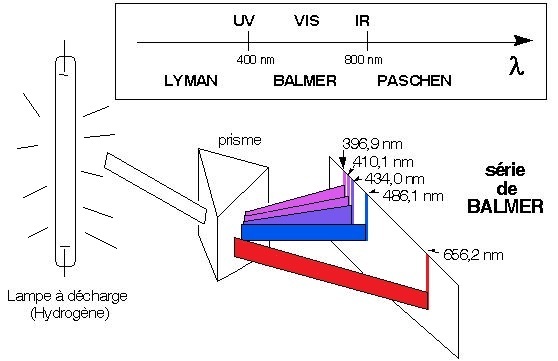
Le spectre de raies de l’atome d'hydrogène
La définition de la structure électronique des atomes a débuté par l’étude de celle de l’atome
d’hydrogène puisqu’il
s’agit
de l’atome le plus simple.
Les hypothèses ont été proposées à partir d’analyses spectrales.
Ces spectres atomiques (spectres de raies) sont obtenus en excitant convenablement un gaz ou
une vapeur de l’élément
à étudier.
Quand l’atome
retourne à l’état fondamental (10-8 seconde), on observe un spectre discontinu de
raies
de
longueurs
d’onde définies.

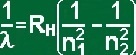
On a pu montrer que les valeurs s’ajustaient sur une loi numérique (formule de Ritz) :
|
RH est la constante de Rydberg, n1 et n2 des entiers avec n2
> n1 On observe des séries de raies dans l'UV (série de Lyman), le visible (série de Balmer), l'IR (série de Paschen), ... |
 |
Pour calculer les longueurs
d'onde, le tableau ci-dessous permet
d'attribuer n1 et n2 :
- n1 est le niveau bas (de retour s'il y a émission)
- n2 est le niveau haut (de départ s'il y a émission)
On propose une écriture non normalisée mais très simple :
λx→y simplifié en λxy
Par exemple,
λ21
désigne la longueur d'onde émise par le passage de l'électron d'un atome
d'hydrogène
du niveau 2
au niveau 1. C'est la première (puisque le niveau immédiatement supérieur à 1
est le niveau 2) raie de Lyman
(puisque l'électron va
au
niveau 1).
|
Série |
Lyman |
Balmer |
Paschen |
Brackett |
Pfund |
|
|
n1 |
1 |
2 |
3 |
4 |
5 |
λ52 désigne la longueur d'onde émise par le passage de l'électron d'un atome d'hydrogène
du niveau 5 au niveau 2.
C'est la troisième raie (départ 3 niveaux au dessus de 2) de Balmer
(arrivée au niveau 2). Il s'agit d'un phénomène d'émission
|
|
Un moyen mnémotechnique pour s'y retrouver dans ces longueurs d'onde ! |