Diagramme des niveaux d’énergie
A partir de la valeur de l’énergie électronique de l’orbitale 1s de l’atome d’hydrogène
E0 = -13,6 eV,
on défini
les valeurs des énergies des orbitales des autres éléments.
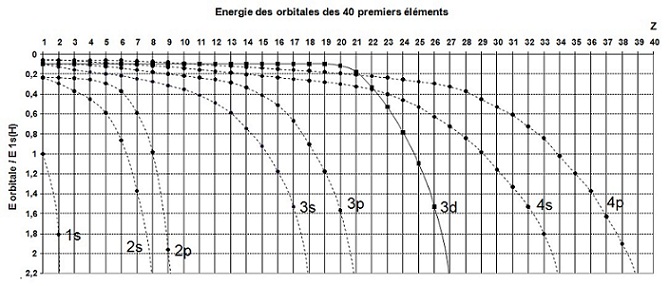
On constate la dégénérescence (ils ont la même énergie) des niveaux 2, 3, … de l’atome d’hydrogène puisque :
- les
courbes
2s et 2p se rejoignent à 0,25 E0 = - 3,4 eV
- les
courbes
3s, 3p et 3d se rejoignent à 0,11 E0 = - 1,5 eV
- …
Par exemple, pour le 7ème élément, l’Azote :
- l’orbitale 2s a une énergie de 1,4 E0 = - 19 eV
- l’orbitale 2p a une énergie de 0,6 E0 = - 8,2 eV
Les courbes sont tracées afin de montrer l'évolution de l'énergie des orbitales en fonction de Z,
il ne s'agit pas de courbes
continues mais de séries de points correspondant aux éléments.
On constate que l’énergie de l’orbitale 3d n’évolue pas comme celle des
orbitales s ou p.
En effet, pour le 21ème élément E4p = E3d
puis pour le 22ème E4s = E3d et
pour
le 23ème E4s et 4p > E3d et il a donc inversion des énergies
à partir de l'élément 23.
Atomistique et liaison chimique
Structure électronique de l'atome
Exercices
![]()
Pr Robert Valls
robert.valls@univ-amu.fr