Energie d’ionisation de l’atome de Chlore :
1- c'est le 17ème élément : Z = 17
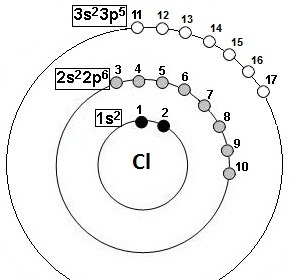
2- structure électronique : 1s22s22p6 3s23p5
3- groupes selon Slater : (1s2)(2s22p 6)(3s23p5)
4- dessin correspondant

5- Énergie électronique totale du Chlore :
Etotale(Cl) = 2E1 + 8E3+ 7E11
6- Énergie électronique totale de l'ion Chlore:
Etotale(Cl+) = 2E1 + 8E3+ 6E'11 (exercice 1)
7- I1 = Etotale (Cl+) - Etotale (Cl) soit I1= 6E'11- 7E11
Z11 = 17 – (6x0,35) – (8x0,85) - (2x1) = 6,1
Z'11= 17 – (5x0,35) – (8x0,85) - (2x1) = 6,45
I1=- Ee11
= [6(6,452
/ 32) - 7(6,12
/ 32)]x (- 13,6 eV) = 16,4 eV
|
|
La première énergie d'ionisation est donc égale à E(dernier groupe d'électron de l'ion) - E(dernier groupe d'électron de l'atome) pour les éléments qui contiennent plus d'un électron dans le dernier groupe de Slater |
On note qu'au plus grand nombre d'électrons (7) est associé le plus petit Z' (6,1) et réciproquement.
Mais ce n'est à utiliser que pour vérifier l'écriture.
Pensez à vérifier vos acquis et cochez les cases
![]() à la première page lorsque vous vous sentez capable de répondre à la requête proposée.
à la première page lorsque vous vous sentez capable de répondre à la requête proposée.