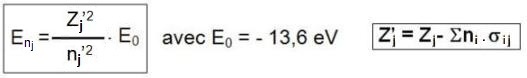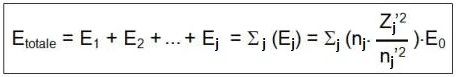STRUCTURE ÉLECTRONIQUE DE L'ATOME
Définir ...
Les règles de Slater
Slater a proposé de remplacer la
charge Z
e
du noyau par une valeur Z’e
qui est la charge apparente du noyau vis à vis
de l’électron j.
On considère que l’électron i joue
un rôle d’écran et minimise l’attraction
exercée par le noyau sur l’électron j.
Les électrons i et j sont situés sur la même couche électronique ou
i peut également être sur une couche
inférieure.
On considère que les électrons des couches supérieures sont ignorés et qu'ils ne minimisent pas l'attraction exercée par
le noyau sur l'électron j (σi→j = 0).
On groupe les électrons de l'atome considéré,
selon Slater : (s et p), (3d), (4f) .... attention, il s'agit de l'ordre des n
et
des sous couche
croissants et non de l'ordre
de remplissage
(on ne croise pas les niveaux).
|
|
|

|
niveau de l'électron (i) qui joue un rôle écran |
|
|
|
σij |
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
4d |
4f |
5s 5p |
|
|
niveau
de
l'électron
considéré
(j)
|
1s |
0,30 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
2s 2p |
0,85 |
0,35 |
0 |
0 |
0 |
0 |
0 |
0 |
|
3s 3p |
1 |
0,85 |
0,35 |
0 |
0 |
0 |
0 |
0 |
|
3d |
1 |
1 |
1 |
0,35 |
0 |
0 |
0 |
0 |
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
0 |
0 |
0 |
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
0 |
0 |
|
4f |
1 |
1 |
1 |
1 |
1 |
1 |
0,35 |
0 |
|
5s
5p |
1 |
1 |
1 |
1 |
0,85 |
0,85 |
0,85 |
0,35 |
σij ou
σi→j est le coefficient d’écran d’un électron i sur l’électron j.
Pour améliorer la correspondance entre les valeurs expérimentales et calculées, Slater a introduit
un nombre quantique apparent (n')
|
|
pour
n = |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
on utilise n’ = |
1 |
2 |
3 |
3,8 |
4 |
4,2 |
Les modifications de n sont liées à l’enchevêtrement des niveaux à partir de n = 4.
| |
Présentation sous forme de texte de la règle de Slater :
- On groupe les électrons de l'atome
considéré,
selon Slater : (1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (4f) (5s, 5p) ....
Attention, il s'agit de l'ordre des n croissant et non de l'ordre
de remplissage (et on groupe les s et les p)
- Pour calculer Z’j (charge apparente du noyau), on retranche à Z :
0 pour
les électrons (i) des groupes supérieurs à celui de l’électron considéré
(j)
0,35 pour les électrons (i) du même groupe
de l’électron considéré (j), sauf 1s pour lequel on utilise 0,30
0,85 si l’électron
(i) est (s, p) pour chaque électron de la couche n-1
et
1 si l’électron
(i) est (s, p) pour chaque électron des couches plus internes
1 si l’électron (i) est (d) ou (f)
pour chaque électron des groupes inférieurs quels qu’ils soient
|
L’énergie de l’électron situé sur le niveau n est donné par l'expression :
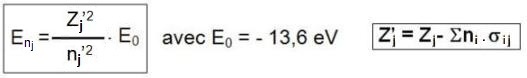
L’énergie électronique totale de l’atome est la somme des énergies de chacun des électrons (j) :
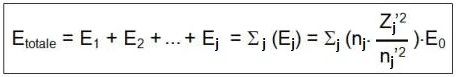 |
où nj est le nombre d’électrons d’un groupe de Slater.
|
E
0 est l’énergie de l’électron 1s de l’atome d’hydrogène (- 13,6 eV).
Les exercices vont permettre d'assimiler parfaitement ces règles
qui sont, en fait, relativement simples.
Atomistique et liaison chimique
Structure électronique de l'atome
Exercices

Pr Robert Valls
robert.valls@univ-amu.fr