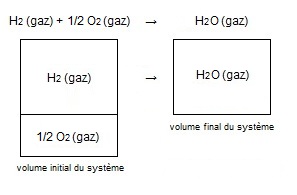
Vf = V [H2O (gaz)] = volume de 1 mole de gaz
Le volume du système a diminué du volume de 0,5 mole
et puisqu'on est à 25°C et 1 atmosphère
le VMolaire = 22,4 L (voir "Pressions partielles et gaz parfaits")
ΔV = - 0,5 x 22,4 L = - 11,2 L
W = - P ΔV = - 101325 x (- 0,5 x 22,4) = + 113484 J
Le travail est positif car le volume du système diminue
donc le système reçoit du travail.