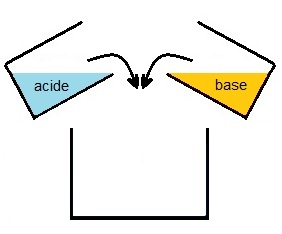
La solution de soude se trouve dans un bécher et celle d'acide dans un
autre.
Le système dans son état initial est donc en deux parties.
On
verse le contenu des deux béchers dans un troisième, vide au départ, et
la réaction à lieu.
Le système dans son état final est limité au contenu du troisième
béchers.
Ces commentaires sont imagés par l'écriture de la réaction : NaOH + HCl → NaCl +
H2O
A gauche de la flèche, le système est dans son état initial.
A droite de la flèche, le système est dans son état final.