Thermodynamique et cinétique chimique
Correction de l'exercice : Deuxième principe - Définir ...
On place deux moles de gaz parfait dans un récipient A sous un bar et il est relié à un récipient
identique B dans lequel on a fait le vide. Lorsqu’on ouvre le robinet de communication, la température
ne varie pas.
Calculer la variation d’entropie totale, la variation d’entropie du système et celle échangée avec
le milieu extérieur.
Si la température ne varie pas, c'est que l'on est en isotherme.
Cela indique aussi que l'échange de chaleur avec le milieu extérieur est nul.
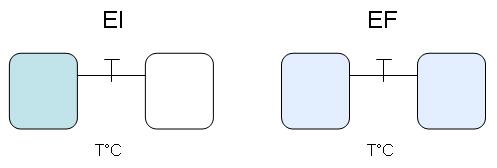
On applique les loi de l'isotherme (voir mémoriser)
.
ΔStotale = n . R . ln (Vf / Vi) = 2 x 8,31 x ln
(2V / V) =
+ 11,5 J.K-1
On en déduit ΔSsystème = ΔStotale - ΔSextérieur
= ΔStotale - 0 = + 11,5 J.K-1
La détente dans le vide est donc irréversible (ΔSsystème > 0)
mais se produit sans échange d'entropie avec le milieu extérieur .
Pensez à revenir à la page
"Savoirs et savoir faire"
pour vérifier vos acquisitions.
Thermodynamique et cinétique Deuxième principe
Isotherme Enoncé
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr

