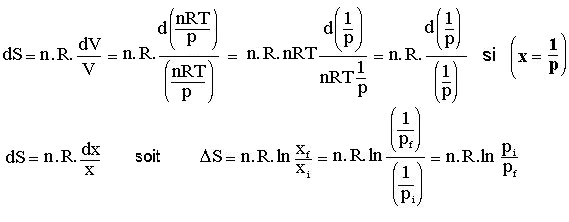
Si la température est constante, on est en isotherme :
On sait que.........ΔU = 0.........et que .........ΔU = Q + W = 0.........donc......... Q = - W or.........W = - p ΔV .........
soit sous forme différentielle.........dQ = - dW = p.dV
|
|
|
dQ |
dV PV |
|
si le chemin est réversible alors |
dS = |
—— = P. |
—— or T = —— (n = 1) |
|
|
|
T |
T nR |
|
|
dQ dV |
dV |
dV |
Vf |
||
|
soit |
—— = P . —— = |
n . R .—— donc dS = |
n . R . —— |
alors |
ΔSext (réversible) = |
n . R . ln —— = ΔStotale |
|
|
T PV |
V |
V |
Vi |
||
|
|
—— |
|
|
|||
|
|
nR |
|
|
ΔSext est l'entropie échangée entre le système et le milieu extérieur
Remarque : on peut aussi faire apparaître la pression
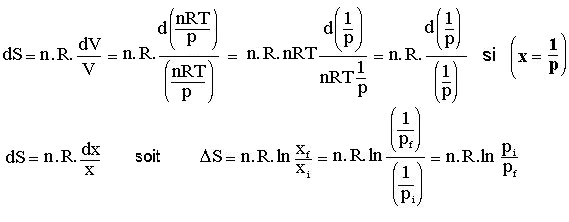
|
|
|
Pf |
|
|
alors |
ΔSext (réversible) = |
- n . R . ln —— = ΔStotale |
(chemin réversible) |
|
|
|
Pi |
|
A retenir
Les relations liées à une transformation isotherme.