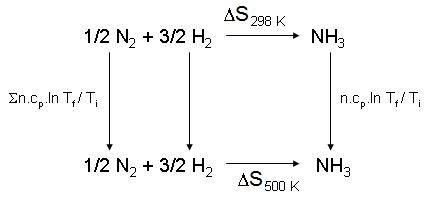
|
Tf |
||
|
On a donc à calculer des entropies totales donc on utilisera |
n.C.ln —— |
|
|
Ti |
|
n.c.ΔT |
|
et non ———— qui donne l'entropie échangée avec l'extérieur. |
|
Text |

| 500 | |
| ΔS500 = ΔS298 + [n.cp(produits) - n.cp(réactifs)].ln | —— |
| 298 |
|
500 |
||
|
ΔS500 = (- 150) + [1 x 33,4 - (29,3 / 2 + 3 x 28,8 / 2)].ln |
—— |
= - 162,7 J.K-1 |
|
298 |
Pensez à revenir à la page
"Savoirs
et savoir faire"
pour vérifier vos acquisitions.
Thermodynamique et cinétique
Deuxième principe
Enoncé
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr