Il faut noter que Q à pression constante = Qp = ΔHp = ΔH
(voir "Energie interne enthalpie").
donc lorsque l'on transfère de la chaleur entre les corps à pression constante,
le bilan réalisé est un
bilan d'enthalpie.
On rappelle que : Q = m . C . ΔT = m . c . ( Tf - Ti ) = Qp
= ΔH
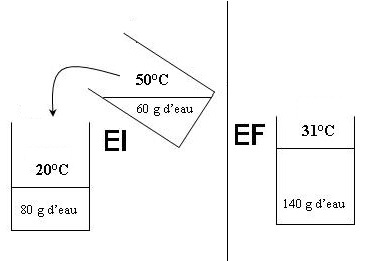
A l'état initial (EI), le
calorimètre et les
80 g d'eau qu'il contient sont à
20°C alors que les
60 g d'eau
qui vont y être versés sont à 50°C. A
l'état final (EF), le
calorimètre et les 80
g d'eau qu'il contient se
sont réchauffés à 31°C et les
60 g d'eau se sont
refroidis à 31°C.
Cliquer sur la figure pour retrouver le schéma initial
La température finale est de 31°C donc
l'eau chaude à 60°C
se refroidit à 31°C
et le calorimètre
et l'eau qu'il contient
se réchauffent.
Ce qui conduit à l'équation suivante :
ce qui se refroidit .......ce
qui se réchauffe
60 . 1 . (31 - 50) +
(80 + mc) . 1 . (31 - 20) = 0
soit - 1140 + 880 + 11 mc
= 0
soit
11 mc = 1140 - 880 = 260 .............
soit
.......... ...mc = 23,6 g
b- Dans ce cas, on connait la masse d'eau à laquelle on peut assimiler le
calorimètre mais on
cherche la température finale.
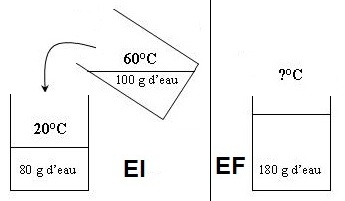
L'écriture est similaire à la précédente :
ce qui
se refroidit ...... .ce
qui se réchauffe
100 . 1 . (Tf - 60)
+ (80 + 23,6) . 1 . (Tf - 20) = 0
soit ...100 Tf - 6000 + 103,6
soit Tf
- 2072 = 0
soit
203,6 Tf = 6000 + 2072 = 8072
soit Tf
= 39,6°C
Pensez à revenir à la page "Savoirs et savoir faire" pour vérifier vos acquisitions.