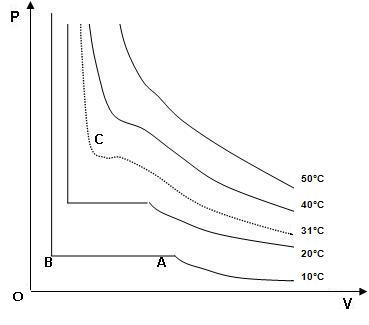
 On trace la zone de liquéfaction qui présente
On trace la zone de liquéfaction qui présenteune forme de "cloche" sous laquelle il y a un
mélange liquide / gaz.
Cliquer sur le diagramme pour retrouver sa
forme initiale
 On trace la zone de liquéfaction qui présente
On trace la zone de liquéfaction qui présente
une forme de "cloche" sous
laquelle il y a un
mélange liquide / gaz.
On peut indiquer les
zones d'existence
de
l'état liquide et gazeux. On remarque que la
zone correspondant à l'état gazeux est
limitée par la courbe en "cloche" puis (à
partir du point critique) par l'isotherme critique.
À partir de 40 °C, on voit apparaître une
déformation qui se traduit en une droite
horizontale aux basses températures.
C'est la droite de liquéfaction.
Le point C est nommé point critique, à partir
de celui-ci on ne peut liquéfier un gaz par
simple
compression.
Pour liquéfier un gaz, généralement, on le comprime et on le refroidit car si la
température est
supérieure à la température critique, il ne pourra se liquéfier.
L'isotherme à 31 °C est tangente à la "cloche" au point critique.
Apartir de B on observe une droite quasi verticale car les liquides sont incompressibles
aussi pour
faire varier faiblement le volume il faut augmenter très fortement la pression.
Pensez à revenir à la page "Savoirs et savoir faire" pour vérifier vos acquisitions.