Thermodynamique et cinétique chimique
CLAPEYRON
Définir ... LE POINT CRITIQUE
La courbe représentative de la fonction P = f (V) a l'allure d'un arc d'hyperbole équilatère
(en effet, P V = n R T soit P = k / V).
Elle se visualise dans les diagrammes (V,O,T) ci-dessous, les courbes
tracées sont des isothermes.
Cliquer sur le diagramme pour retrouver sa
forme initiale
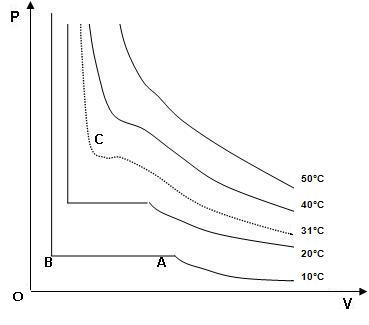 À partir d'une certaine température, on voit apparaître une
À partir d'une certaine température, on voit apparaître une
déformation.
Le point C est nommé point critique, à partir de celui-ci on ne
peut liquéfier un gaz par simple
compression.
L’isotherme correspondante définit la température critique
(Tc, ici 31 °C).
L'isotherme à 10 °C est un "arc d'hyperbole" jusqu'au point A,
ensuite on observe une horizontale jusqu'au point B (liquéfaction),
enfin, à partir de B on observe une droite quasi verticale (liquides
incompressibles).
La zone de liquéfaction présente une forme de "cloche" sous
laquelle il y a un
mélange liquide / gaz.
On peut aussi indiquer sur le diagramme les
zones d'existence
du liquide et du gaz.
UTILISATION DU DIAGRAMME P = f (V)
Lorsque l'on comprime de façon isotherme un gaz à température inférieure à la température critique,
le gaz commence
à se liquéfier à une certaine pression (PM) et la liquéfaction se poursuit à
cette pression
jusqu'au point B (il n'y a alors que
du liquide) à partir duquel on observe une quasi verticale
(les liquides étant incompressibles).
Dans le diagramme de Clapeyron (P,O,V) l'isotherme présente un
palier horizontal de liquéfaction
à partir du point A.
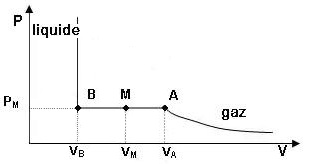 Avant
le point A le gaz est comprimé et son volume diminue
Avant
le point A le gaz est comprimé et son volume diminue
parallèlement à sa pression qui augmente pour suivre l'isotherme.
Du point A au point B, il y a
liquéfaction du gaz et la pression est
constante.
A partir du point B, le gaz est
totalement liquéfié et pour une très
faible variation du volume, il faut augmenter fortement la pression.
Cliquer sur le diagramme pour faire apparaitre la figure
initiale.
Il est possible de déterminer le pourcentage de liquide et de gaz correspondant à tout point M situé
entre A et B.
|
|
AM |
|
Le rapport |
—— donne la proportion de liquide dans le mélange. |
|
|
AB |
|
Si M est en A, il y a AA / AB = 0 donc 0% de liquide (effectivement il n'y a que du gaz au point A). |
|
|
MB |
|
Le rapport |
—— donne la proportion de gaz dans le mélange. |
|
|
AB |
|
Si M est en B, il y a AB / AB = 1 donc 100% de liquide (effectivement il n'y a que du
liquide au point B). |
Thermodynamique et cinétique
Clapeyron
Exercices
Pr Robert Valls & Dr Richard Frèze
robert.valls@univ-amu.fr
 À partir d'une certaine température, on voit apparaître une
À partir d'une certaine température, on voit apparaître une 