Définir ... DIAGRAMME D’ÉQUILIBRE ENTRE DEUX PHASES D’UN CORPS PUR
Si un corps pur peut exister sous deux phases, cet équilibre est
univariant, la pression d'équilibre est uniquement
fonction de la température.

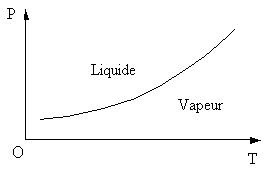
On représente sur le plan (P,O,T) la courbe P = f(T),
il s'agit du diagramme d'équilibre.
Chaque point indique par ses coordonnées les conditions de
température et de pression à réaliser
pour
obtenir l'équilibre.
Pour l'équilibre liquide-vapeur, on parlera de courbe de vaporisation.
Hors de la courbe il n'y a qu'une
seule
phase (liquide
ou vapeur).
Ce type de courbe est limité dans le domaine des pressions élevées
au point critique
(voir cours) et dans le
domaine
des faibles
pressions par
le point triple (voir cours).
Pour l'équilibre cristal-liquide, on parlera de courbe de fusion.
On remarque qu'il y a deux groupes de composés suivant qu'ils :
augmentent de volume en fondant ou
diminuent
de volume en fondant
(la plupart des composés)
(glace, gallium, antimoine, ...)

Remarque : ces courbes ne concernent pas les solides qui se décomposent sans fondre (leur
température de fusion
n'est pas comprise dans
leur domaine de pureté).
Avant de traiter des exercices, il faut continuer
la lecture du cours.